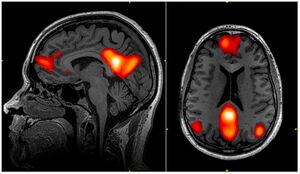
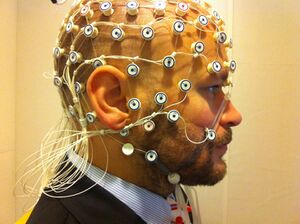
动态功能连接
动态功能连接(DFC)是功能神经影像领域的最新进展,指功能连接随时间发生变化的现象,是对传统静态功能连通性分析的一个新的拓展其目的是,在稳态连接研究这一新型领域中对时间变异性的观察。DFC与多种不同的神经系统疾病有关,并被认为是一种更精确的脑功能网络表征。分析 DFC 的主要工具是功能磁共振成像(fMRI),但是 DFC 也可以被其他几种技术观察到。
概述和历史
静息态连接
功能性连接是指在空间大脑区域之间的功能性整合关系。与在大脑中寻找物理连接的结构连接不同,功能性连接与不同大脑区域中相似的激活模式有关,而不考虑这些区域的物理性连接[1]。这种类型的连接性在20世纪90年代中期被提出,假设在一个任务或一段时间的数据收集过程中,大脑中的功能连接保持不变,并且主要使用fMRI和正电子发射计算机断层扫描成像(PET)技术来观察[2]。功能性连接通常在静息状态fMRI期间进行测量,并且通常根据相关性、连贯性和空间分组进行分析。研究表明,功能连接与各种不同任务中的行为有关。
动态分析的起源
动态分析的起源研究表明,依赖脑状态的功能性连接变化是描述时间差异显著的首要指标。功能性连接的变化,与多种不同的原因有关,如心理任务[3]、睡眠[4]和学习[5]。这些变化通常与行为,与高水平的思想或意识有很大关系[6]。
DFC的重要发现
对动态功能连接的分析表明,大脑的功能网络远非完全静止,而是在秒到分钟的范围内波动。这些变化通常被看作是从一个短期状态到另一个短期状态的变化,而不是连续的变化[6]。许多研究表明,网络活动的重复模式在整个大脑中移动。这些模式在动物和人类大脑都可以观察到,并且在扫描过程中只出现在某些时间点上[7]。除了显示短暂的大脑状态,DFC 分析还显示了大脑网络的明显分层组织。双侧对称区域之间的连接是大脑中最稳定的连接形式,其次是其他有直接解剖连接的区域。稳态功能连接网络存在并具有生理相关性,但时间稳定性低于解剖网络。最后,一些功能性网络转瞬即逝,只能通过 DFC 分析才能看到。这些网络也具有生理相关性,但与大脑中的其他网络相比,其时间稳定性要差得多[8]。
分析方法
滑动窗口法
滑动窗口分析是功能性连接分析中最常用的方法,2009年 Sakoglu 和 Calhoun 首次提出,并应用于精神分裂症(schizophrenia)[9][10][11][12]。滑动窗口分析是通过对 fMRI中的一组扫描进行分析来执行的。扫描次数是滑动窗口的长度。然后将定义的窗口及时向前移动一定数量的扫描并执行附加分析。窗口的移动通常以相邻窗口之间的重叠程度来表示。滑动窗口分析的一个主要优点是,如果窗口长度足够大,几乎任何稳态分析都可以使用滑动窗口进行。滑动窗口分析还具有易于理解和在某些方面更易于解释的优点[6]。滑动窗口分析作为最常用的动态分析方法,已经被用于研究 DFC 的各种不同特征和含义。研究人员使用这种分析方法,在患病和健康的患者、认知任务中表现优秀和表现差的患者以及大规模大脑状态之间,显示出不同的 DFC 特征。
模式分析法
对fMRI图像进行模式分析(pattern analysis),是有史以来最早用于分析DFC的方法之一,该方法用以表明空间分离的脑区存在着趋于同步活动(synchronous activity)的激活模式(activation pattern)。目前已知大脑中存在一种空间周期性(spatial periodicity)和时间周期性(temporal periodicity),这种周期性可能反映了大脑的一些恒定过程(constant processes)。有人认为,大脑网络信息的重复模式占fMRI BOLD数据变化的25-50%。[7][13]。上述重复的活动模式在大鼠身上主要被看作是大脑皮层同步活动的传播波(propagating wave),该波被证明与潜在的神经活动有关,并且在人类和大鼠中都存在[7]。
点过程分析法
通过将fMRI的 BOLD 数据转化为点过程[14][15]。提出了一种时间分辨率更高的的方法来分析快速变化的功能激活模式,。点过程分析与传统方法不同,是通过为每个体素选择 BOLD 信号的拐点(即峰值)来实现的,拐点包含了很大一部分与功能连接有关的信息。已经证明,尽管数据大小大大减少(>95%) ,但是它与使用完整信号的标准方法所得到的功能连接的推论相比还是很好的[16][17]。
这些观点所包含的大量信息与 Petridou 等人的结果是一致的[18]。他通过从静息数据中去除任务血流动力学反应函数,证明了这些“自发事件”对缓慢自发波动的相关强度和功率谱的贡献。随后,以共活化模式(CAP)的名义成功地应用了类似的原理。[19][20][21]
其他方法
时频分析已被提出作为一种分析方法,能够克服与滑动窗口相关的许多挑战。与滑动窗口分析不同,时频分析允许研究人员同时研究频率和幅度信息。小波变换已被用于进行 DFC 分析,通过显示其在时间上的显着变化来验证 DFC 的存在。这种相同的方法最近被用来研究接受网络的一些动态特征。例如,时频分析表明,默认模式网络和任务正向网络之间的反相关在时间上不是恒定的,而是一种暂时的状态[22]。独立分量分析已成为稳态功能连通性中最常用的网络生成方法之一。 ICA 将 fMRI 信号分成几个具有相似时间模式的空间分量。最近,ICA 已被用于将 fMRI 数据划分为不同的时间分量。这被称为时间 ICA,它已被用于绘制网络行为,该行为占 fMRI 中解剖节点相关性变异性的 25%。[23]
争议和局限
一些研究人员认为,DFC 可能是扫描仪或生理噪声的简单反映。 fMRI 中的噪声可能来自多种不同的因素,包括心跳、血脑屏障的变化、采集扫描仪的特性或分析的意外影响。 一些研究人员提出,fMRI 研究中功能连接的可变性与人们通过简单分析随机数据所期望的可变性是一致的。 最近通过观察 fMRI DFC 数据的电基础和 DFC 特征的行为相关性,这种关于 DFC 可能仅反映噪声的疑虑已经减少。[6]
除了怀疑 DFC 可能是扫描仪噪声的产物外,观察到的 DFC 可能会因用于观察它的 fMRI 的间接性质而受到批评。 通过使用回波平面成像快速获取一系列 MRI 图像来收集 fMRI 数据。 这些图像中的对比度受到含氧和脱氧血液比例的严重影响。 由于活跃的神经元比静止的神经元需要更多的能量,因此这种对比的变化传统上被解释为对神经活动的间接测量。 由于其间接性质,DFC 研究中的 fMRI 数据可能被批评为是非神经信息的反映。 最近观察到的 fMRI DFC 和同时获得的电生理数据之间的相关性已经缓解了这种担忧。[24]
生理学证据
fMRI是研究 DFC 的主要手段。这带来了独特的挑战,因为fMRI的时间解析度相当低,通常为0.1赫兹,而且只是对神经活动的间接测量。
多模态方法
电生理
一些科学家认为 DFC 和电生理学之间的相关性可以反映神经元群体单细胞分析中动态网络行为的血流动力学结果。虽然血流动力学反应太慢,不能反映神经网络动力学的双射,但是 DFC 似乎可以反映电生理学数据的某些频率的幂值[6]。
在人类中,脑电图(EEG)也被用来验证和解释 DFC 中的观测结果。脑电信号的空间分辨率很低,因为它只能获取头皮表面的数据,但它反映了许多神经元的广泛电活动。脑电图和fMRI同时被用来解释 FC 中的部分扫描间变异。脑电图也被用来表明 FC 的变化与在脑电图中观察到的广泛的大脑状态有关。[24][25][26][27]
脑磁图
脑磁图(MEG)可以用来测量大脑电活动所产生的磁场。脑磁图具有很高的时间解析度分辨率,并且一般比脑电图具有更高的空间分辨率。脑磁图静息状态的研究仍然受到空间分辨率的限制,但是通道已经被用来表明静息状态网络经历了低水平和高水平的相关周期。这一观察结果与其他 DFC 研究结果一致,如 DFC 激活模式分析[6]。
行为基础
DFC 已被证明与人的表现,包括警觉性和注意力方面显著相关。人们已经提出并支持任务开始前的网络行为是该任务性能的一个强有力的预测指标。传统上,fMRI的研究主要集中在大脑区域的激活幅度作为性能的预测,但最近的研究表明,滑动窗口分析测量的网络之间的相关性是一个更强的性能预测[28]。功能连接变异性(FCV)在功fMRI扫描滑动窗口的个体差异已被证明与关注疼痛的倾向相关[29]。一个主体走神离开感官刺激的程度也与 FCV 有关[30]。
与临床的关联
DFC 分析的主要动机之一是更好地理解、检测和治疗神经系统疾病。静态功能连接性已被证明与多种疾病如抑郁症、精神分裂症和阿尔茨海默病有显著的相关性。由于该领域的新颖性,DFC 只是最近才被用于研究疾病状态,但自2012年以来,这三种疾病都被证明与功能连接的动态时间特征相关。这些差异大多与在不同的瞬态状态下所花费的时间有关。精神分裂症患者的状态变化不如健康患者频繁,这一结果导致了这样的推测,即这种疾病与患者陷入某种大脑状态有关,在这种状态下,大脑无法对不同的队列做出快速反应[31]。此外,一项视觉感官网络的研究表明,精神分裂症受试者比健康受试者在中颞回与视觉感官网络其他区域之间的连接高度负面的状态下花费更多的时间[32]。阿尔茨海默病的研究表明,患有这种疾病的病人改变了网络连接,也改变了现有网络中的时间[33]。DFC 与疾病之间的观察相关性并不意味着 DFC 的变化是任何这些疾病的原因,但 DFC 分析的信息可用于更好地了解疾病的影响,并更快速和准确地诊断这些疾病。
参考文献
- ↑ Friston, Karl (2011). "Functional and Effective Connectivity: a review". Brain Connectivity. 1 (1): 13–36. CiteSeerX 10.1.1.222.9471. doi:10.1089/brain.2011.0008. PMID 22432952.
- ↑ Biswal, B.; Zerrin Yetkin, F. Z.; Haughton, V. M.; Hyde, J. S. (1995). "Functional connectivity in the motor cortex of resting human brain using echo-planar MRI". Magnetic Resonance in Medicine. 34 (4): 537–541. doi:10.1002/mrm.1910340409. PMID 8524021. S2CID 775793.
- ↑ Esposito, F.; Bertolino, A.; Scarabino, T.; Latorre, V.; Blasi, G.; Popolizio, T.; Tedeschi, G.; Cirillo, S.; Goebel, R.; Di Salle, F. (2006). "Independent component model of the default-mode brain function: Assessing the impact of active thinking". Brain Research Bulletin. 70 (4–6): 263–269. doi:10.1016/j.brainresbull.2006.06.012. PMID 17027761. S2CID 23195652.
- ↑ Horovitz, S. G.; Fukunaga, M.; De Zwart, J. A.; Van Gelderen, P.; Fulton, S. C.; Balkin, T. J.; Duyn, J. H. (2008). "Low frequency BOLD fluctuations during resting wakefulness and light sleep: A simultaneous EEG-fMRI study". Human Brain Mapping. 29 (6): 671–682. doi:10.1002/hbm.20428. PMC 6871022. PMID 17598166.
- ↑ Bassett, D. S.; Wymbs, N. F.; Porter, M. A.; Mucha, P. J.; Carlson, J. M.; Grafton, S. T. (2011). "Dynamic reconfiguration of human brain networks during learning". Proceedings of the National Academy of Sciences. 108 (18): 7641–7646. arXiv:1010.3775. Bibcode:2011PNAS..108.7641B. doi:10.1073/pnas.1018985108. PMC 3088578. PMID 21502525.
- ↑ 6.0 6.1 6.2 6.3 6.4 6.5 Hutchison, R. M.; Womelsdorf, T.; Allen, E. A.; Bandettini, P. A.; Calhoun, V. D.; Corbetta, M.; Della Penna, S.; Duyn, J. H.; Glover, G. H.; Gonzalez-Castillo, J.; Handwerker, D. A.; Keilholz, S.; Kiviniemi, V.; Leopold, D. A.; De Pasquale, F.; Sporns, O.; Walter, M.; Chang, C. (2013). "Dynamic functional connectivity: Promise, issues, and interpretations". NeuroImage. 80: 360–378. doi:10.1016/j.neuroimage.2013.05.079. PMC 3807588. PMID 23707587.
- ↑ 7.0 7.1 7.2 Majeed, W.; Magnuson, M.; Keilholz, S. D. (2009). "Spatiotemporal dynamics of low frequency fluctuations in BOLD fMRI of the rat". Journal of Magnetic Resonance Imaging. 30 (2): 384–393. doi:10.1002/jmri.21848. PMC 2758521. PMID 19629982.
- ↑ Gonzalez, Castillo; J. Wu; P. Robinson; M. Handwerker; D. Inati; S. Bandettini (2012). Detection of task transitions on 45mins long continuous muli task runs using whole brain connectivity. Biennial Resting state Conference. Magdeburg, Germany.
- ↑ Sakoglu, U.; Calhoun, V. D. (2009). "Dynamic windowing reveals task-modulation of functional connectivity in schizophrenia patients vs healthy controls" (PDF). Proc. ISMRM. 17: 3675.
- ↑ Sakoglu, U.; Calhoun, V. D. (2009). "Temporal Dynamics of Functional Network Connectivity at Rest: A Comparison of Schizophrenia Patients and Healthy Controls". NeuroImage. 47 (Suppl. 1): S169. doi:10.1016/S1053-8119(09)71811-7. S2CID 54291742.
- ↑ Sakoglu, U.; Michael, A. M.; Calhoun, V. D. (2009). "Classification of schizophrenia patients vs healthy controls with dynamic functional network connectivity". NeuroImage. 47 (Suppl. 1): S57. doi:10.1016/S1053-8119(09)70216-2. S2CID 54432053.
- ↑ Sakoglu, U.; Pearlson, G. D.; Kiehl, K. A.; Wang, Y. M.; Michael, A. M.; Calhoun, V. D. (2010). "A method for evaluating dynamic functional network connectivity and task-modulation: application to schizophrenia". Magnetic Resonance Materials in Physics and Medicine (MAGMA). 23 (6): 351–366. doi:10.1007/s10334-010-0197-8. PMC 2891285. PMID 20162320.
- ↑ Majeed, W.; Magnuson, M.; Hasenkamp, W.; Schwarb, H.; Schumacher, E. H.; Barsalou, L.; Keilholz, S. D. (2011). "Spatiotemporal dynamics of low frequency BOLD fluctuations in rats and humans". NeuroImage. 54 (2): 1140–1150. doi:10.1016/j.neuroimage.2010.08.030. PMC 2997178. PMID 20728554.
- ↑ Tagliazucchi, Enzo; Balenzuela, Pablo; Fraiman, Daniel; Montoya, Pedro; Chialvo, Dante R. (2011-01-20). "Spontaneous BOLD event triggered averages for estimating functional connectivity at resting state". Neuroscience Letters. 488 (2): 158–163. doi:10.1016/j.neulet.2010.11.020. PMC 3014405. PMID 21078369.
- ↑ Tagliazucchi, Enzo; Balenzuela, Pablo; Fraiman, Daniel; Chialvo, Dante R. (2012-01-01). "Criticality in large-scale brain fMRI dynamics unveiled by a novel point process analysis". Frontiers in Physiology. 3: 15. doi:10.3389/fphys.2012.00015. PMC 3274757. PMID 22347863.
- ↑ Tagliazucchi, Enzo; Carhart-Harris, Robin; Leech, Robert; Nutt, David; Chialvo, Dante R. (2014-11-01). "Enhanced repertoire of brain dynamical states during the psychedelic experience". Human Brain Mapping (in English). 35 (11): 5442–5456. arXiv:1405.6466. Bibcode:2014arXiv1405.6466T. doi:10.1002/hbm.22562. ISSN 1097-0193. PMC 6869695. PMID 24989126.
- ↑ Tagliazucchi, Enzo; Siniatchkin, Michael; Laufs, Helmut; Chialvo, Dante R. (2016-01-01). "The voxel-wise functional connectome can be efficiently derived from co-activations in a sparse spatio-temporal point-process". Frontiers in Neuroscience. 10: 381. doi:10.3389/fnins.2016.00381. PMC 4994538. PMID 27601975.
- ↑ Petridou, Natalia; Gaudes, César Caballero; Dryden, Ian L.; Francis, Susan T.; Gowland, Penny A. (2013-06-01). "Periods of rest in fMRI contain individual spontaneous events which are related to slowly fluctuating spontaneous activity". Human Brain Mapping (in English). 34 (6): 1319–1329. doi:10.1002/hbm.21513. ISSN 1097-0193. PMC 6869909. PMID 22331588.
- ↑ Liu, Xiao; Duyn, Jeff H. (2013-03-12). "Time-varying functional network information extracted from brief instances of spontaneous brain activity". Proceedings of the National Academy of Sciences (in English). 110 (11): 4392–4397. Bibcode:2013PNAS..110.4392L. doi:10.1073/pnas.1216856110. ISSN 0027-8424. PMC 3600481. PMID 23440216.
- ↑ Liu, Xiao; Chang, Catie; Duyn, Jeff H. (2013-01-01). "Decomposition of spontaneous brain activity into distinct fMRI co-activation patterns". Frontiers in Systems Neuroscience. 7: 101. doi:10.3389/fnsys.2013.00101. PMC 3913885. PMID 24550788.
- ↑ Chen, Jingyuan E.; Chang, Catie; Greicius, Michael D.; Glover, Gary H. (2015-05-01). "Introducing co-activation pattern metrics to quantify spontaneous brain network dynamics". NeuroImage. 111: 476–488. doi:10.1016/j.neuroimage.2015.01.057. PMC 4386757. PMID 25662866.
- ↑ Chang, C.; Glover, G. H. (2010). "Time–frequency dynamics of resting-state brain connectivity measured with fMRI". NeuroImage. 50 (1): 81–98. doi:10.1016/j.neuroimage.2009.12.011. PMC 2827259. PMID 20006716.
- ↑ Weissman-Fogel, I.; Moayedi, M.; Taylor, K. S.; Pope, G.; Davis, K. D. (2010). "Cognitive and default-mode resting state networks: Do male and female brains "rest" differently?". Human Brain Mapping. 31 (11): 1713–1726. doi:10.1002/hbm.20968. PMC 6870948. PMID 20725910.
- ↑ 24.0 24.1 Thompson, G. J.; Merritt, M. D.; Pan, W. J.; Magnuson, M. E.; Grooms, J. K.; Jaeger, D.; Keilholz, S. D. (2013). "Neural correlates of time-varying functional connectivity in the rat". NeuroImage. 83: 826–836. doi:10.1016/j.neuroimage.2013.07.036. PMC 3815981. PMID 23876248.
- ↑ Tagliazucchi, E; von Wegner, F; Morzelewski, A; Brodbeck, V; Laufs, H (2012). "Dynamic BOLD functional connectivity in humans and its electrophysiological correlates". Frontiers in Human Neuroscience. 6: 339. doi:10.3389/fnhum.2012.00339. PMC 3531919. PMID 23293596.
- ↑ Chang, C; Liu, Z; Chen, M. C.; Liu, X; Duyn, J. H. (2013). "EEG correlates of time-varying BOLD functional connectivity". NeuroImage. 72: 227–36. doi:10.1016/j.neuroimage.2013.01.049. PMC 3602157. PMID 23376790.
- ↑ Mehrkanoon, S; Breakspear, M; Boonstra, T. W. (2014). "Low-dimensional dynamics of resting-state cortical activity". Brain Topography. 27 (3): 338–52. doi:10.1007/s10548-013-0319-5. PMID 24104726. S2CID 16494240.
- ↑ Thompson, G. J.; Magnuson, M. E.; Merritt, M. D.; Schwarb, H.; Pan, W. J.; McKinley, A.; Tripp, L. D.; Schumacher, E. H.; Keilholz, S. D. (2013). "Short-time windows of correlation between large-scale functional brain networks predict vigilance intraindividually and interindividually". Human Brain Mapping. 34 (12): 3280–3298. doi:10.1002/hbm.22140. PMC 6870033. PMID 22736565.
- ↑ Kucyi, A; Salomons, T. V.; Davis, K. D. (2013). "Mind wandering away from pain dynamically engages antinociceptive and default mode brain networks". Proceedings of the National Academy of Sciences. 110 (46): 18692–7. Bibcode:2013PNAS..11018692K. doi:10.1073/pnas.1312902110. PMC 3832014. PMID 24167282.
- ↑ Kucyi, A; Davis, K. D. (2014). "Dynamic functional connectivity of the default mode network tracks daydreaming". NeuroImage. 100: 471–80. doi:10.1016/j.neuroimage.2014.06.044. PMID 24973603. S2CID 13082197.
- ↑ Damaraju, E.; J. Turner; A. Preda; T. Erp Van; D. Mathalon; J.M. Ford; S. Potkin; V.D. Calhoun (2012). "Static and dynamic functional network connectivity during resting state in schizophrenia". American College of Neuropsychopharmacology.
- ↑ Sendi, M.S.E.; Godfrey D. Pearlson; Daniel H. Mathalon; J.M. Ford; A. Preda; T. Erp Van; V.D. Calhoun (2021). "Multiple overlapping dynamic patterns of the visual sensory network in schizophrenia". Schizophrenia Research. 228: 103–111. doi:10.1016/j.schres.2020.11.055. PMID 33434723. S2CID 231391460.
- ↑ Jones, D. T.; Vemuri, P.; Murphy, M. C.; Gunter, J. L.; Senjem, M. L.; Machulda, M. M.; Przybelski, S. A.; Gregg, B. E.; Kantarci, K.; Knopman, D. S.; Boeve, B. F.; Petersen, R. C.; Jack Jr, C. R. (2012). He, Yong (ed.). "Non-Stationarity in the "Resting Brain's" Modular Architecture". PLOS ONE. 7 (6): e39731. Bibcode:2012PLoSO...739731J. doi:10.1371/journal.pone.0039731. PMC 3386248. PMID 22761880.
Category:Neuroimaging
类别: 神经影像学
This page was moved from wikipedia:en:Dynamic functional connectivity. Its edit history can be viewed at 动态功能连接/edithistory