“本征微观态”的版本间的差异
小 (→微观态与宏观态) |
|||
| 第73行: | 第73行: | ||
我们不妨用一个简单的例子来介绍微观态与宏观态。 | 我们不妨用一个简单的例子来介绍微观态与宏观态。 | ||
| − | 设想一个大盒子里,放有100个完全相同的硬币。盖上盒盖后,用力并持续足够长的时间摇晃盒子,随后打开盒盖朝里看,有些硬币正面朝上,有些硬币反面朝上 <ref name=": | + | 设想一个大盒子里,放有100个完全相同的硬币。盖上盒盖后,用力并持续足够长的时间摇晃盒子,随后打开盒盖朝里看,有些硬币正面朝上,有些硬币反面朝上 <ref name=":1" group="note" />,有大量可以获得的可能组态(准确地说,应该是<math>2^{100}</math>种,大约为<math>10^{30}</math>)。这里我们假定,这些不同组态中的每一种,均是等可能出现的。因此每种可能组态出现的概率约为<math>10^{-30}</math>。我们称上述每一种特定的组态(configuration),为该系统的一个微观态(microstate)。这些微观态的某一个例子是:“一号硬币正面朝上,二号硬币正面朝上,三号硬币反面朝上,……,一百号硬币反面朝上”。为了辨别一个微观态,我们可能需要单独地辨别每一个硬币,这的确令人烦躁,但是这毕竟只是在简单地数数:有多少硬币正面朝上,有多少硬币反面朝上(例如,有53枚正面朝上,47枚反面朝上)。这样的分类称为该系统的一个宏观态(macrostate)。但值得注意的是,每个宏观态并不是等可能出现的。例如,在约为<math>10^{30}</math>个可能的组态(微观态)中,50枚硬币正面朝上,50枚硬币反面朝上的组态数为<math>\frac{100!}{50!×50!}≈4×10^{27}</math>;53枚硬币正面朝上,47枚硬币反面朝上的组态数为<math>\frac{100!}{53!×47!}≈3×10^{27}</math>;100枚硬币正面朝上,0枚硬币反面朝上的组态数为1。 |
这样看来,100枚硬币正面全朝上的结果是不太可能发生的,因为这个宏观态只含有一个的微观态。当然,有53枚正面和47枚反面的一个特定微观态也同样是不太可能发生,这是因为还有将近<math>3×10^{27}</math>个有53枚正面和47枚反面的、看上去极端相似的其他微观态存在。 | 这样看来,100枚硬币正面全朝上的结果是不太可能发生的,因为这个宏观态只含有一个的微观态。当然,有53枚正面和47枚反面的一个特定微观态也同样是不太可能发生,这是因为还有将近<math>3×10^{27}</math>个有53枚正面和47枚反面的、看上去极端相似的其他微观态存在。 | ||
2022年9月7日 (三) 10:33的版本
理论背景
系综(统计系综)
如果我们用概率来描述热系统,采用的方法一般是,设想一次又一次地重复某一个实验,来测量某一个系统的某一种性质,因为我们无法控制它们的微观性质(由系统的微观态所描述),在尝试表述这个方法时,乔赛亚·威拉德·吉布斯(Josiah Willard Gibbs)在1902年提出了系综的概念 [1]。这是一种理想化的方法,在该方法中他考虑对系统进行大量想象的“影印”,其中每一个都代表了该系统所处的一个可能状态。
在物理学,特别是在统计物理学中,在统计物理中,系综代表一定条件下,一个体系的大量可能状态的集合。换句话说,系综是系统状态的一个概率分布。对一相同性质的体系,其微观状态(比如每个粒子的位置和速度)仍然可以大不相同。更进一步地说,统计系综是统计力学中用来描述单一系统的一组粒子系统 [2]。
下面举一个例子来说明这样的表述。考虑抛一枚硬币的实验,这样一个简单的实验只有两种可能的结果,“正面”或“反面”[note 1]。原则上,如果我们能够确切地知道硬币是如何被抛出的,以及与硬币和桌子相互作用力等等信息,那么只要根据经典力学的理论进行一定的计算,实验的结果应该是完全可以预测的。实际上,关于这个实验详细的、精确的信息是无法获取的。所以对于某一次实验结果,我们不可能作出唯一的预测,可是实验的统计表述却是比较简单的。
我们只要考虑由很大数目,[math]\displaystyle{ N }[/math]枚相似的硬币组成的一个系综,当这些硬币以同样的方式抛出,我们可以数出结果中硬币正反面的个数,进而得到正面的概率[math]\displaystyle{ p }[/math]和反面的概率[math]\displaystyle{ q }[/math]。统计理论希望能够预测这些概率。
现在考虑稍微复杂一点的掷N枚硬币的实验,由于抛掷任何一枚硬币都有两个可能的结果,那么掷N枚硬币就可以出现[math]\displaystyle{ 2×2×2×…×2=2^N }[/math]个可能结果中的任何一个。如果不是只讨论一组[math]\displaystyle{ N }[/math]枚硬币,而是考虑[math]\displaystyle{ N }[/math]个这样的组(每组有[math]\displaystyle{ N }[/math]枚硬币)所组成的系综,每组都以相似的方式抛掷硬币,那么值得我们探究的问题便是,[math]\displaystyle{ 2^N }[/math]个可能结果中,任何一个特殊的结果在系综中出现的概率为多大。
“平衡系综”的概念对统计系综的许多应用至关重要。如果每一时刻体系的统计系综中,呈现任一特殊事件的体系数目是一样的(或等价地表示为:如果这个系综中任一特殊事件出现的概率与时间无关),那么就说这个系综是与时间无关的。换句话说,尽管一个机械系统肯定会随着时间的推移而演变,但系综并不一定会发生演变。事实上,如果系综包含了系统的所有过去和未来阶段,那么它就不会演变。这样的统计描述就为平衡提供一个非常清楚的定义:如果孤立宏观体系的一个统计系综是与时间无关的,那么这样一个体系就称为处于平衡[1]。
吉布斯定义了三种主要的系综[1]:
(1)微正则系综(microcanonical ensemble):系综里的每个体系具有相同的能量[1]。
(2)正则系综(canonical ensemble):系综里的各体系可以和外界环境交换能量,这种能量交换将确定(并且定义)了系统的温度[1]。
(3)巨正则系综(grand canonical ensemble):是正则系综的推广,各体系可以和外界环境交换能量和粒子,但系综内各个体系有相同的温度和化学势[1]。
在系综中,物理量的变化范围与其本身大小的比值会随着体系的增大而减小。那么对于一个宏观体系来说,从各种系综计算出的物理量的差异将趋于零。
相变
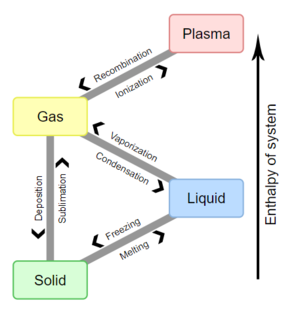
在化学、热力学和其他许多相关领域,相变(或相位变化)是指介质的一种状态(由某些参数确定)和另一种状态(参数值不同)之间的过渡物理过程。这个术语通常用于指固体、液体和气体,等离子体(少数情况下)等物质的基本状态之间的变化。
举例来说,热力学系统的一个阶段和物质状态具有统一的物理特性。在某一介质的相变过程中,由于外部条件的变化,如温度、压强或其他条件的变化,介质的某些属性发生的变化,往往是不连续的。比如液体在加热到沸点时,可能变成气体,导致体积的突然变化。这种对发生转变的外部条件的测度,称为相变。相变通常发生在自然界中,并且今天在许多技术中也常常被使用。
保罗·埃伦费斯特(Paul Ehrenfest)提出了如下关于相变的一种分类 [3] :相变的级(order)是在[math]\displaystyle{ T_C }[/math]处吉布斯自由能[math]\displaystyle{ G }[/math](或者[math]\displaystyle{ \mu }[/math])的微分显示不连续性的最低的阶数。那么一级相变(rstorder phase transition)包含潜热,因为熵[math]\displaystyle{ S }[/math]([math]\displaystyle{ G }[/math]的一阶微分)此时显示出不连续性,体积[math]\displaystyle{ V }[/math](也是[math]\displaystyle{ G }[/math]的一阶微分)也显示出一个并不连续的跳跃 [4]。热容[math]\displaystyle{ C }[/math]是[math]\displaystyle{ G }[/math]的二阶微分,并且也显示出一个尖锐的跳跃,压缩系数[math]\displaystyle{ \beta }[/math]也是如此。一级相变的例子包括固液相变、固气相变以及气液相变。
根据埃伦费斯特的分类,二级相变(second-order phase transition)没有潜热,因为熵[math]\displaystyle{ S }[/math]没有显示出不连续性,并且体积[math]\displaystyle{ V }[/math]也没有不连续性,但是如热容[math]\displaystyle{ C }[/math]和压缩系数[math]\displaystyle{ \beta }[/math]等量却依然不连续 [4]。二级相变的例子包括超导相变,或者[math]\displaystyle{ \beta }[/math]黄铜中的有序无序转变。
然而,在研究相变时我们所使用的这种方法,存在一个很大的问题。我们在热力学中常所作这样一个近似,粒子的数目很大,以至于平均性质(如压强和密度)能够被很好地定义,但这种近似在相变时将会失效。在接近相变时,涨落增加,所以在非常接近相变温度时,系统的行为并不遵循我们所预期的分析。在所有的长度标度下,这个临界区域会由涨落所表征。
不符合埃伦费斯特分类的相变的第一个例子是1944年由拉尔斯·昂萨格(Lars Onsager)发现的Ising模型的精确解。在接下来的几十年里,埃伦费斯特分类法被一个简化的分类方案所取代,这个方案不在此过多赘述,感兴趣的读者可以参见相变。
临界点与临界现象
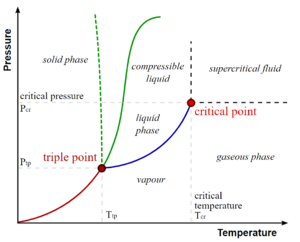
在热力学中,一个临界点(或临界状态)就是相平衡曲线的终点。最突出的例子是液-汽临界点,它是压力-温度曲线的终点,它指明了液体和其蒸汽可以共存的条件。在较高的温度下,气体不能仅靠压力来液化。在由临界温度[math]\displaystyle{ T_C }[/math]和临界压力[math]\displaystyle{ p_C }[/math]定义的临界点,相边界消失。其他例子包括混合物中的液-液临界点,以及在没有外部磁场的情况下的铁磁体-准磁体转变 [5]。
为使表述简单明晰,临界点的一般概念我们通过液体-蒸汽临界点来介绍。
右图显示了纯物质的P-T图。众所周知,固相、液相和汽相通过相边界分离,即两相可以共存的压力-温度组合。在三相点,所有三个相可以共存。然而,在临界温度[math]\displaystyle{ T_C }[/math]和临界压力[math]\displaystyle{ p_C }[/math]时,液-汽边界终止于一个点,也就是临界点。
在临界点附近,液体和蒸汽的物理性质发生了巨大变化,两相变得越来越相似。在临界点,只有一个相存在。这意味着在临界点:[6][7][8]
- [math]\displaystyle{ \left(\frac{\partial p}{\partial V}\right)_T = 0, }[/math]
- [math]\displaystyle{ \left(\frac{\partial^2p}{\partial V^2}\right)_T = 0. }[/math]
由右图可见,液相和气相区域之间的边界线在临界点终结,因此有可能通过选取一条穿过相图、避免不连续变化的路径“逃脱”清晰的相变。对于高于临界温度(如水为647K)的温度,气态和液态仅可以通过它们的密度来区分。气态和液态之间的转变不涉及对称性的变化,所以可通过围绕临界端点改变状态,从而避免明显的相变。与此相比较,固液相变涉及对称性的变化,因此熔化曲线没有临界点。关于更多涉及对称性的变化的定义与示例,参见对称性破缺。
平衡态与非平衡态
“平衡”这个词意味着一种平衡的状态。平衡热力学,通常被认为起源于对卡诺循环的分析。在这个典型的系统里,比如一缸气体,最初处于其自身的内部热力学平衡状态,通过燃烧反应的热输入而失去平衡。然后通过一系列的步骤,随着系统进入最终的平衡状态,功被释放出来。
在平衡态下,系统内的热力学势或驱动力处于完全平衡状态。平衡热力学的一个核心目标是:给定一个处于明确的热力学平衡初始状态的系统,受到被精确规定的约束,计算当约束被外部施加的干预改变时,一旦系统达到新的平衡,系统的状态将会是什么。平衡态在数学上是通过寻求热力学势函数的极值来确定的,其性质取决于施加在系统上的约束。例如,在恒定温度和压力下的化学反应,将在吉布斯自由能[math]\displaystyle{ G }[/math]最小和熵[math]\displaystyle{ S }[/math]最大时达到平衡 [9]。
平衡热力学与非平衡热力学不同,对于后者而言,被分析系统的状态通常不是均匀的,而是在能量[math]\displaystyle{ E }[/math]、熵[math]\displaystyle{ S }[/math]和温度[math]\displaystyle{ T }[/math]分布上会发生局部变化。相比之下,在平衡热力学中,系统的状态将被认为是均匀的,由温度、压力或体积等量宏观定义的。系统是根据从一个平衡状态到另一个平衡状态的变化来研究的,这样的变化被称为热力学过程。
几乎所有在自然界中发现的系统都不是在热力学平衡中,因为它们正在随着时间变化或者可以被触发而发生变化,并且不断地和其他系统交换物质和能量以及参与化学反应。然而,某些系统和过程在某些程度上足够接近于热力学平衡态,允许目前已有的非平衡态热力学对其进行可行的精确描述。然而,在许多自然系统和过程中,由于非变分动力学的存在,使得自由能的概念并不存在,因此总是远远超出非平衡热力学方法的范围 [10]。
对于平衡态的研究,使用了“准静态过程”的理想化概念。准静态过程是一种概念上沿着热力学平衡状态连续路径的平滑数学过程。它只可能是微分几何的练习,而不是现实中可能发生的过程 [11]。此外,非平衡态热力学试图描述连续的时间进程,这需要它的状态变量与平衡态热力学的状态变量之间有非常密切的联系。这极大地限制了非平衡态热力学的范围,并对其概念框架提出了严格的要求 [12]。
不同于前文所述的平衡态,非平衡态要复杂得多,它可能存在更多广延量的涨落。边界条件施加给它们某些强度量,如温度梯度或形变集体运动(剪切运动、涡旋等),通常称为热力学力。在这里,我们必须强调,这里并没有像平衡态热力学中熵的热力学第二定律那样定义能量的静态非平衡性质的一般定律。这就是为什么在这种情况下,应该考虑一个更一般的Legendre变换(也就是拓展的马休势,extended Massieu function)。
微观态与宏观态
我们不妨用一个简单的例子来介绍微观态与宏观态。
设想一个大盒子里,放有100个完全相同的硬币。盖上盒盖后,用力并持续足够长的时间摇晃盒子,随后打开盒盖朝里看,有些硬币正面朝上,有些硬币反面朝上 [note 2],有大量可以获得的可能组态(准确地说,应该是[math]\displaystyle{ 2^{100} }[/math]种,大约为[math]\displaystyle{ 10^{30} }[/math])。这里我们假定,这些不同组态中的每一种,均是等可能出现的。因此每种可能组态出现的概率约为[math]\displaystyle{ 10^{-30} }[/math]。我们称上述每一种特定的组态(configuration),为该系统的一个微观态(microstate)。这些微观态的某一个例子是:“一号硬币正面朝上,二号硬币正面朝上,三号硬币反面朝上,……,一百号硬币反面朝上”。为了辨别一个微观态,我们可能需要单独地辨别每一个硬币,这的确令人烦躁,但是这毕竟只是在简单地数数:有多少硬币正面朝上,有多少硬币反面朝上(例如,有53枚正面朝上,47枚反面朝上)。这样的分类称为该系统的一个宏观态(macrostate)。但值得注意的是,每个宏观态并不是等可能出现的。例如,在约为[math]\displaystyle{ 10^{30} }[/math]个可能的组态(微观态)中,50枚硬币正面朝上,50枚硬币反面朝上的组态数为[math]\displaystyle{ \frac{100!}{50!×50!}≈4×10^{27} }[/math];53枚硬币正面朝上,47枚硬币反面朝上的组态数为[math]\displaystyle{ \frac{100!}{53!×47!}≈3×10^{27} }[/math];100枚硬币正面朝上,0枚硬币反面朝上的组态数为1。
这样看来,100枚硬币正面全朝上的结果是不太可能发生的,因为这个宏观态只含有一个的微观态。当然,有53枚正面和47枚反面的一个特定微观态也同样是不太可能发生,这是因为还有将近[math]\displaystyle{ 3×10^{27} }[/math]个有53枚正面和47枚反面的、看上去极端相似的其他微观态存在。
这个简单的例子说明两个关键点:
(1)可以用数量巨大的同等可能的微观态描述一个系统;
(2)实际测量的是系统宏观态的一个性质.各个宏观态并不是同等可能出现的,因为不同宏观态对应不同数量的微观态。
系统最可能所处的宏观态是对应于最多微观态数的宏观态。
热系统的行为与上面考虑的例子中的情况非常类似。要指定一个热系统的一个微观态,就需要给出系统中每一个原子的微观位形 [note 1](configuration,可能是位置和速度或者能量)。通常不可能测量出系统处在哪一个微观态。另一方面,仅仅给出一个热系统的宏观性质(如压强,总能量或者体积)就能指定该系统的个宏观态。举例来说,在体积1m^3中压强为105Pa的气体的一个宏观位形,通常会与大量的微观态相联系。
定义
演化的傅里叶谱分析
本征微观态和相变的凝聚
本征微观态重整化群理论
重整化群
本征微观态的重整化群变换
在Ising模型上的应用
应用
在平衡系统中
在地球系统中
在金融系统中
在生命系统中
在交通系统中
注释
参考资料
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Gibbs, Josiah Willard (1902). Elementary Principles in Statistical Mechanics. New York: Charles Scribner's Sons.
- ↑ Rennie, Richard; Jonathan Law (2019). Oxford Dictionary of Physcis. pp. 458 ff. ISBN 978-0198821472.
- ↑ Jaeger, Gregg (1 May 1998). "The Ehrenfest Classification of Phase Transitions: Introduction and Evolution". Archive for History of Exact Sciences. 53 (1): 51–81. doi:10.1007/s004070050021. S2CID 121525126.
- ↑ 4.0 4.1 Blundell, Stephen J.; Katherine M. Blundell (2008). Concepts in Thermal Physics. Oxford University Press. ISBN 978-0-19-856770-7.
- ↑ Stanley, H. Eugene (1987). Introduction to phase transitions and critical phenomena. New York: Oxford University Press. ISBN 0-19-505316-8. OCLC 15696711. https://www.worldcat.org/oclc/15696711.
- ↑ P. Atkins and J. de Paula, Physical Chemistry, 8th ed. (W. H. Freeman 2006), p. 21.
- ↑ K. J. Laidler and J. H. Meiser, Physical Chemistry (Benjamin/Cummings 1982), p. 27.
- ↑ P. A. Rock, Chemical Thermodynamics (MacMillan 1969), p. 123.
- ↑ Mortimer, R. G. Physical Chemistry, 3rd ed., p. 157, Academic Press, 2008.
- ↑ Bodenschatz, Eberhard; Cannell, David S.; de Bruyn, John R.; Ecke, Robert; Hu, Yu-Chou; Lerman, Kristina; Ahlers, Guenter (December 1992). "Experiments on three systems with non-variational aspects". Physica D: Nonlinear Phenomena. 61 (1–4): 77–93. doi:10.1016/0167-2789(92)90150-L.
- ↑ Herbert Callen|Callen, H.B. (1960/1985), § 4–2.
- ↑ Glansdorff, P., Prigogine, I. (1971), Ch. II,§ 2.