树突
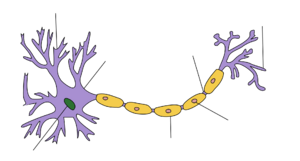
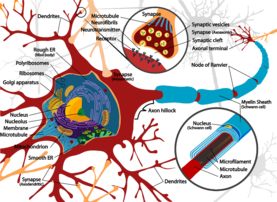
树突(源于希腊语 δνδρν déndron,树的意思),是神经细胞的分枝状的原生质延伸,可接收其他神经细胞传递的电化学刺激,并传播到该细胞的胞体。电刺激信号由上游神经元(通常通过其轴突)经树突分支各处的突触传递到树突上。树突在整合这些突触输入以及决定神经元动作电位发放起着关键作用[1]。树突分枝形成,是个多步骤的生物过程,藉此神经元形成新的树突分支和分叉,以创建新突触[1]。树突的形态如分支密度和分组模式与神经元的功能密切相关。树突畸形也与神经系统功能损伤高度相关。与树突畸形有关的疾病包括自闭症、抑郁症、精神分裂症、唐氏综合症和焦虑症。
某些类型的树突具有称为树突棘的小突起,其增强树突的信号接收特性,通过隔离增强信号的特异性。树突棘的神经活动增强和长时程增强会改变其大小、形状和传导性能。这种树突生长能力被认为在学习和记忆形成中起着重要作用。每个细胞可以有多达 15,000 个树突棘,每个树突棘都可以作为单个突触前轴突的突触后突起[2]。树突分支可以非常庞大,有的可以为单个神经元接收多达 100,000 个输入[3]。
树突是从神经元胞体延伸出来的两种原生质突起之一,另一种是轴突。轴突与树突可以通过几个特征来区分,包括形状、长度和功能。树突有逐渐变细的形状,更短,而轴突一般粗细不变,相对较长。通常,轴突传递电化学信号,而树突接收电化学信号,尽管某些种类的神经元没有轴突,仅仅通过树突传递信号[4] 。树突提供了扩大的表面区域来接收来自其他轴突末梢的信号,轴突也通常在其远端形成许多分支(终树突),每个分支形成一个神经末梢,允许一种化学信号同时传递给许多目标细胞[3] 。电化学信号,通常在树突部位,刺激神经元,并引起神经元质膜电位的变化。这种膜电位的变化会在整个树突进行被动扩布,但随着距离的增加而变弱,不会产生动作电位。动作电位沿着神经元树突的细胞膜传递电活动到胞体,然后沿着轴突传递到轴突末梢,在那里触发神经递质释放到突触间隙[3]。然而,有树突的突触也可以是轴树突触,即从轴突向树突传递信号,也可以是树树突触,即树突之间传递信号[5]。自突触是神经元的轴突将信号传递给自身树突的突触。
神经元有三种主要类型:多极、双极和单极。多极神经元,如图所示,由一个轴突和许多树突组成。锥体细胞是多极的皮层神经元,具有锥形的胞体和延伸到皮层表面的称为顶树突的大树突。双极神经元在胞体相对的两端分别有一个轴突和一个树突树。单极神经元有一根柄从细胞体延伸出来,分成两个分支,一个分支包含树突,另一个分支包含末梢。单极树突被用来检测感觉刺激,如触摸或温度[5][6][7]。
历史
树突(dendrite)一词最早是在 1889 年被 Wilhelm His 用来描述神经细胞相连的较小的“原生质突起”的数量[8] 。德国解剖学家 Otto Friedrich Karl Deiters 被认为发现了轴突,是他首先将轴突与树突区分开。
1930 年代末,Kenneth S. Cole 和 Howard J. Curtis 最先开始对神经系统进行胞内电生理记录。瑞士人 Rüdolf Albert von Kölliker 和德国人 German Robert Remak 首先对轴突起始段进行了鉴定和性质研究。1952 年,Alan Hodgkin 和 Andrew Huxley 也使用了乌贼巨突触(1939年),到 1952 年他们得到动作电位的离子机制的完整定量描述,从而建立了 Hodgkin-Huxley 模型。Hodgkin 和 Huxley 因这项工作在 1963 年共同获得诺贝尔奖。Frankenhaeuser-Huxley 方程式则将将刻画轴突传导的公式推广到脊椎动物。Louis-Antoine Ranvier 首次描述了轴突上的不连续或结,因此这些轴突特征现在通常被称为郎飞结。西班牙解剖学家 Ramón y Cajal 提出轴突是神经元输出的部分[9]。他还指出,神经元是离散的细胞,通过细胞间的特殊连接或空隙,即今天称为突触的结构进行相互通信。Ramón y Cajal 改进了他的竞争对手 Camillo Golgi 发明的高尔基染色法[10]。
树突发育
在树突的发育过程中,有几个因素可以影响这种分化,包括感觉输入调控、环境污染物、体温和药物使用[11] 。例如,在黑暗环境中长大的大鼠,初级视皮层的锥体细胞的树突棘数量减少,在第 4 层星形细胞中树突分支的分布有明显的不同[12] 。体外和体内实验表明,传入神经和传入神经活动本身可以调节树突分化的模式[13]。
树突如何在体内定向,并产生特定神经元类别特有的复杂分支模式,我们对这个过程仍知之甚少。树突分支发育机制的一个理论是突触营养假设。突触营养假设认为,突触前细胞向突触后细胞的输入(以及兴奋性突触输入的成熟)最终可以改变树突和轴突末梢的分支形成突触的进程[14] 。这种突触形成对工作中的大脑的神经元结构发育是所必需的。树突复杂分支的形成的代谢成本和覆盖感受野的需要之间的平衡大体决定了树突的大小和形状。一系列复杂的胞外和胞内信号,包括转录因子、配体受体相互作用、各种信号通路、局部翻译机制、细胞骨架元件、高尔基前哨和核内体,都会调节树突发育。这些促进了单个细胞胞体上树突的组织以及这些树突在神经回路中的定位。例如,研究表明 β 肌动蛋白结合蛋白1(β-actin zipcode binding protein 1,ZBP1)在树突形成正常分支中发挥作用。其它与树突形态有关的重要转录因子包括 CUT、stump、Collier、Spineless、ACJ6/drifter、CREST、NEUROD1、CREB、neurog2 等。分泌蛋白和细胞表面受体包括神经营养因子和酪氨酸受体激酶、BMP7、Wnt/dishevelled、EPHB 1-3、 Semaphorin/plexin-neuropilin、slit-robo、netrin-frazzled、reelin。Rac, CDC42 和 RhoA 作为细胞骨架调节分子,马达蛋白包括 KIF5、dynein、LIS1。控制树突发育的重要分泌和内吞途径包括 DAR3/SAR1、DAR2/Sec23、DAR6/rab1 等。所有这些分子在控制树突形态发生,包括细胞类型特异的树突分支、树突大小和不同神经元树突的组织中相互作用[1][15]。
电性质
神经元树突的结构和分支模式,以及电压门控离子通道的表达与种类,强烈地影响着神经元如何整合来自其他神经元的输入。这种整合既包含时间整合,即快速连续到达的刺激的总和,也包含空间整合,即来自不同分支的兴奋性和抑制性输入的聚合[16]。
之前认为树突只是被动地传导电刺激。这种被动传输意味着,在细胞体上测量到的电压变化是远端突触激活产生的电信号,在没有电压门控离子通道的帮助下,向胞体传播的结果。被动电缆理论描述了树突特定位置的电压变化如何通过向胞体汇聚的不同直径、长度和电性质的树突段组成的系统传输这种电信号。基于被动电缆理论,人们可以探究神经元树突形态的变化如何影响胞体的膜电位,从而了解树突的结构体系变化如何影响神经元的整体输出特性[17][18]。
电化学信号可以利用动作电位进行传播,动作电位使用电压门控离子通道跨膜转运钠离子、钙离子和钾离子。每种离子在细胞膜的脂质双分子层中都有其对应的蛋白通道。神经元的细胞膜覆盖轴突、胞体、树突等。不同离子的蛋白质通道具有不同的激活电位和持续时间[3]。
动物细胞的动作电位是由质膜上的钠门控或钙门控的离子通道产生的。这些通道在膜电位接近细胞的静息电位时是关闭的。随着膜电位增加,通道将开始打开,使钠离子或钙离子流入细胞。随着更多的离子进入细胞,膜电位会继续上升。这个过程一直持续到所有的离子通道都打开,导致膜电位的快速增加,然后触发膜电位的减少。去极化是因为钠离子打开,然后钠离子外流。然后激活钾离子通道,钾离子外流,将电化学梯度带回到静息电位。动作电位发生后,由于额外的钾电流,膜电位会有一个短暂的负移,称为后超极化或不应期。这种机制可以阻止动作电位逆向传播[3][19]。
树突的另一个重要特征,是能够将动作电位传回树突分支,这是由其发挥作用的电压门控电导赋予的。这些被称为反向传播动作电位的信号使树突轴去极化,是突触调制和长时程增强的重要过程。此外,在胞体人为产生一串反向传播动作电位可以在特定类型的神经元的树突起始区诱导钙的动作电位(树突发放)。
可塑性
树突在动物包括无脊椎动物的成年阶段似乎能够发生可塑性变化。神经元树突有称为功能单元的各种分区,它们能够对传入的刺激进行计算。这些功能单元由树突棘、分支或分支组等树突子结构组成,对输入进行处理。因此,导致树突结构变化的可塑性将影响细胞的通信和处理。在发育过程中,树突形态是由细胞基因组编码的内在程序和来自其他细胞的信号等外部因子塑造的。但在成年阶段,相比于发育阶段,外部信号相比于内源信号,对树突结构的影响更为显著。女性在怀孕、哺乳、动情周期等激素诱导的生理状态会引起树突结构的变化。这在海马 CA1 区的锥体细胞中尤其明显,其树突密度的变化可达 30% [13]。
笔记
- ↑ 1.0 1.1 1.2 Urbanska, M.; Blazejczyk, M.; Jaworski, J. (2008). "Molecular basis of dendritic arborization". Acta Neurobiologiae Experimentalis. 68 (2): 264–288. PMID 18511961.
- ↑ Koch, C.; Zador, A. (February 1993). "The Function of Dendritic Spines: Devices Subserving Biochemical Rather Than Electrical Compartmentalization". The Journal of Neuroscience. 13 (2): 413–422. doi:10.1523/JNEUROSCI.13-02-00413.1993. PMC 6576662. PMID 8426220.
- ↑ 3.0 3.1 3.2 3.3 3.4 Alberts, Bruce (2009). Essential Cell Biology (3rd ed.). New York: Garland Science. ISBN 978-0-8153-4129-1.
- ↑ Yau, K. W. (1976). "Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech". The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ↑ 5.0 5.1 Carlson, Neil R. (2013). Physiology of Behavior (11th ed.). Boston: Pearson. ISBN 978-0-205-23939-9.
- ↑ Pinel, John P.J. (2011). Biopsychology (8th ed.). Boston: Allyn & Bacon. ISBN 978-0-205-83256-9.
- ↑ Jan, Y. N.; Jan, L. Y. (2010). "Branching out: Mechanisms of dendritic arborization". Nature Reviews Neuroscience. 11 (5): 316–328. doi:10.1038/nrn2836. PMC 3079328. PMID 20404840.
- ↑ Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. pp. 44. ISBN 9780195146943. OCLC 27151391. "The nerve cell with its uninterrupted processes was described by Otto Friedrich Karl Deiters (1834-1863) in a work that was completed by Max Schultze (1825-1874) in 1865, two years after Deiters died of typhoid fever. This work portrayed the cell body with a single chief "axis cylinder" and a number of smaller "protoplasmic processes" (see figure 3.19). The latter would become known as "dendrites", a term coined by Wilhelm His (1831-1904) in 1889."
- ↑ Debanne, D; Campanac, E; Bialowas, A; Carlier, E; Alcaraz, G (Apr 2011). "Axon physiology" (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732.
- ↑ López-Muñoz, F (October 2006). "Neuron theory, the cornerstone of neuroscience, on the centenary of the Nobel Prize award to Santiago Ramón y Cajal". Brain Research Bulletin. 70 (4–6): 391–405. doi:10.1016/j.brainresbull.2006.07.010. PMID 17027775. S2CID 11273256.
- ↑ McEwen, Bruce S. (2010). "Stress, sex, and neural adaptation to a changing environment: mechanisms of neuronal remodeling". Annals of the New York Academy of Sciences. 1204: 38–59. Bibcode:2010NYASA1204...38M. doi:10.1111/j.1749-6632.2010.05568.x. PMC 2946089. PMID 20840167.
- ↑ Borges, S.; Berry, M. (15 July 1978). "The effects of dark rearing on the development of the visual cortex of the rat". The Journal of Comparative Neurology. 180 (2): 277–300. doi:10.1002/cne.901800207. PMID 659662. S2CID 42749947.
- ↑ 13.0 13.1 Tavosanis, G. (2012). "Dendritic structural plasticity". Developmental Neurobiology. 72 (1): 73–86. doi:10.1002/dneu.20951. PMID 21761575. S2CID 2055017.
- ↑ Cline, H; Haas, K (Mar 15, 2008). "The regulation of dendritic arbor development and plasticity by glutamatergic synaptic input: a review of the synaptotrophic hypothesis". The Journal of Physiology. 586 (6): 1509–17. doi:10.1113/jphysiol.2007.150029. PMC 2375708. PMID 18202093.
- ↑ Perycz, M.; Urbanska, A. S.; Krawczyk, P. S.; Parobczak, K.; Jaworski, J. (2011). "Zipcode Binding Protein 1 Regulates the Development of Dendritic Arbors in Hippocampal Neurons" (PDF). Journal of Neuroscience. 31 (14): 5271–5285. doi:10.1523/JNEUROSCI.2387-10.2011. PMC 6622686. PMID 21471362. Archived (PDF) from the original on 2017-09-22.
- ↑ Kandel, Eric R. (2003). Principles of neural science. (4th ed.). Cambridge: McGrawHill. ISBN 0-8385-7701-6. https://archive.org/details/isbn_9780838577011.
- ↑ Koch, Christof (1999). Biophysics of computation : information processing in single neurons. New York [u.a.]: Oxford Univ. Press. ISBN 0-19-510491-9.
- ↑ Häusser, Michael (2008). Dendrites (2nd ed.). Oxford: Oxford University Press. ISBN 978-0-19-856656-4.
- ↑ Barnett, MW; Larkman, PM (Jun 2007). "The action potential". Practical Neurology. 7 (3): 192–7. PMID 17515599.
参考文献
- Lorenzo, L. E.; Russier, M; Barbe, A; Fritschy, J. M.; Bras, H (2007). "Differential organization of gamma-aminobutyric acid type a and glycine receptors in the somatic and dendritic compartments of rat abducens motoneurons". The Journal of Comparative Neurology. 504 (2): 112–26. doi:10.1002/cne.21442. PMID 17626281. S2CID 26123520.
编辑推荐
集智课程
神经动力学模型读书会
人类大脑是一个由数以百亿计的神经元相互连接所构成的复杂系统。近年来,脱胎于系统科学的动力学建模方法,逐渐被广泛地应用于神经科学研究中,其作为一种绝佳的数理工具,愈发地受到研究人员的重视,在类脑计算、脑认知原理解析和脑重大疾病致病机理探索等具体方面,发挥着不可替代的作用。该读书会主要围绕神经科学中基于多尺度建立动力学模型的方式方法,以及其在脑疾病病理探索,脑认知原理解析方面的具体应用进行讨论。
读书会概览
- 大脑的多尺度动力学建模
大脑的动力学建模可以涵盖不同的时间和空间尺度。例如,微观尺度上神经元层面的神经元细胞膜模型(Hodgkin-Huxley),它描述神经元动作电位的启动和传播;宏观尺度上群体神经元层面的动力学模型(NeuralMassModel)和神经场模型(NeuralFieldModel)等,它描述脑区不同群体神经元的动态演化。上述模型均为平均场模型,可进一步拓展为基于结构耦合的全脑动力学模型,它描述跨脑区之间的信息传递。
- 动力学模型和机器学习模型的融合
传统动力学模型的表达能力有限,难以准确描述具有个体特异性的大脑动力学过程。将动力学模型和机器学习模型进行融合从而可以得到针对特定个体数据的动力学模型,如Physics-informed neural network以及NeuralODE模型。这样的模型同时具有类似于传统动力学模型的可解释性和源于机器学习的较强表达能力。
- 动力学模型在脑疾病、脑认知、类脑计算中的应用
广义来说,神经动力学模型可提供一种可控的方式(调整刺激参数和靶点等)激励、抑制或中断大脑网络动态变化,从而实现疾病治疗或脑功能增强。在癫痫研究中,神经动力学模型或可更早地告诉我们大脑已经进入临界状态,从而更好地预测癫痫发作,并发现易受影响的大脑区域,使用药物、神经调控或手术等方法,降低癫痫发作的可能性或者治愈癫痫。已有的工作通过平均场模型揭示了知觉决策过程动力学的机制,还进一步将网络模型拓展到多任务情形,精妙地展示了神经系统通过动力学行为执行认知功能的神经计算机制。同时,神经动力学模型可以为新一代人工神经网络的算法提供指导思想,也可以为下一代专用和通用神经形态芯片提供计算框架。例如当前的一个研究热点为如何利用生物神经系统的实验概念和最新发现,来发展下一代的基于脉冲计算的人工智能。
本中文词条由神经动力学模型读书会志愿者 okxy 翻译审校,薄荷编辑,如有问题,欢迎在讨论页面留言。
本词条内容源自wikipedia及公开资料,遵守 CC3.0协议。