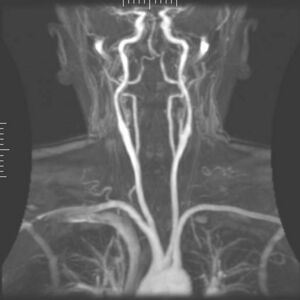
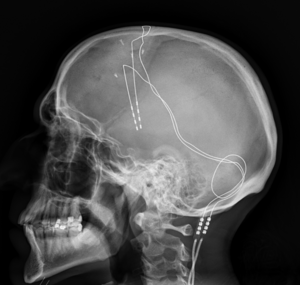
“深部脑刺激”的版本间的差异
(→编者推荐) |
|||
| 第158行: | 第158行: | ||
---- | ---- | ||
| − | + | 本中文词条神经动力学读书会词条梳理志愿者喵喵子翻译审校,[[用户:薄荷|薄荷]]编辑,如有问题,欢迎在讨论页面留言。 | |
2022年8月30日 (二) 17:05的最新版本
脑深部电刺激 Deep brain stimulation (DBS)是神经外科手术中的操作之一,包括放置一种叫做神经刺激器的医疗设备,通过植入的电极将电脉冲发送到大脑中的特定目标(脑核) ,治疗包括帕金森病、原发性震颤、肌张力障碍[1]和其他疾病,如强迫症(OCD)和癫痫,引起的运动障碍。虽然其基本原理和机制尚不完全清楚,DBS 是一种可控的直接改变大脑活动的方式[2][3]。
1997年,DBS 已经被美国食品和药物管理局批准用于治疗原发性震颤(PD)和帕金森病[4]。2003年被批准,以“脑起搏器”的方法用于肌张力障碍[5] ,2009年被批准用于强迫症,2018年用于癫痫[6][7][8]。DBS 已经在临床试验中被研究用作各种情感障碍(包括重度抑郁症的慢性疼痛的潜在治疗方法。这是少数允许盲法研究的神经外科手术之一[1]。
医疗用途
帕金森氏病
DBS用于治疗帕金森病的一些无法用药完全控制的症状[9][10]。通过对丘脑内外侧、内苍白球和丘脑下核(STN)三个靶结构应用高频(> 100 Hz)刺激治疗PD,以模拟病变的临床效果[11]。它适合推荐给药物控制不充分的运动波动和震颤的PD患者,或对药物不耐受的患者,只要他们没有严重的神经精神问题[12] 。在帕金森病中,有苍白球内、丘脑、丘脑下核和桥脚核四个脑区使用神经刺激器进行治疗。然而,在常规手术中,大多数DBS手术不是针对苍白球内,就是针对丘脑下核。
- 苍白球内的DBS减少了不可控的震颤运动,称为运动障碍。这使患者能够服用足够数量的药物(特别是左旋多巴),从而更好地控制症状。
- 丘脑底核深部脑刺激可直接减轻帕金森病症状。这可以减少抗帕金森药物的剂量。
- PPN的DBS可能有助于步态冻结,而丘脑的DBS可能有助于颤抖。这些靶标通常不被使用。
选择正确的 DBS 目标是一个复杂的过程。多种临床特征被用来选择目标,包括识别最棘手的症状、患者目前正在服用的左旋多巴的剂量、当前药物的作用和副作用以及同时出现的问题。例如,丘脑下核 DBS 可能会加重抑郁症,因此对于无法控制的抑郁症患者来说并不是首选。
一般来说,DBS 与运动成绩评定的30-60% 的改善有关[13]。
Tourette综合症
DBS已被实验性地用于治疗对常规治疗没有反应的成人严重Tourette综合症。尽管早期的成功被广泛宣传,DBS治疗图雷特氏症仍然是一个高度实验性的程序,需要更多的研究来确定长期的好处是否大于风险[14][15][16][17] 。该手术耐受性良好,但并发症包括“电池寿命短,停止刺激后症状突然恶化,轻度躁狂或躁狂转化,以及优化刺激参数所需的大量时间和精力”[18] 。截至2006年,有5人被报告患有TS;所有人都经历了抽搐的减少和强迫行为的消失[18]。
这种手术具有侵入性,费用昂贵,需要长期的专家护理。考虑到在荷兰进行的这种手术效果较差,重度抽动秽语综合症的益处还不能下结论。抽动秽语综合症在儿童群体中更为常见,成年后趋于缓解,所以一般不推荐在儿童身上使用这种疗法。因为抽动秽语综合症的诊断是基于症状的历史而不是神经活动的分析,所以如何为特定的人应用 DBS 并不总是很清楚。由于担心使用DBS治疗抽动秽语综合症,美国图雷特协会召集了一组专家来制定建议,指导DBS治疗TS的使用和潜在的临床试验[19]。
Robertson 报告说,截至2011年,DBS 已经在55名成年人身上使用,在当时仍然是一种试验性的治疗方法,并且建议这种手术“应该只由有经验的功能性神经外科医生进行,这些医生所在的中心还有一个专门的图雷特氏综合症诊所”[15] 。根据Malone等人的说法(2006年) ,“只有患有严重的、使人衰弱的和治疗难以治愈的疾病的患者才应该被考虑; 而那些有严重的人格障碍和物质滥用问题的患者应该被排除在外“"[18]。Du 等人(2010)说,“作为一种侵入性治疗,DBS 目前仅适用于严重受影响、治疗难治性 TS 的成年人”[16] 。Singer (2011年)说,“在确定患者选择标准和仔细控制的临床试验结果之前,建议采取谨慎的方法”[14]。Viswanathan等人(2012)表示,DBS 应该用于“严重功能障碍且无法医学治疗”的患者。[20]
不良反应
DBS具有大手术的风险,并发症的发生率与手术团队的经验有关。主要并发症包括出血(1-2%)和感染(3-5%)[21]。
DBS 有可能导致神经精神方面的副作用,包括冷漠、幻觉、性欲亢进、认知功能障碍、抑郁和欣快感。然而,这些影响可能是暂时的,与(1)电极的正确放置,(2)开环VS闭环刺激,意味着持续刺激或人工智能监测传输系统[22],以及(3)刺激器的校准有关,因此这些副作用可能是可逆的[23]。
因为在手术过程中大脑可能会轻微移动,电极可能会从特定位置移位或移位。这可能会导致更深刻的并发症,如个性的改变,但电极错位使用CT扫描相对容易识别。此外,手术并发症也可能发生,如脑出血。手术后,脑组织肿胀、轻度定向障碍和嗜睡均属正常。2-4周后,进行随访,拆除缝合线,打开神经刺激器,并对其进行编程。
游泳技能受损被认为是该手术的一个意外风险;几名帕金森氏症患者在接受脑深部刺激后失去了游泳能力[24][25]。
机制
DBS 的确切作用机制尚不清楚[26]。各种各样的假说试图解释 DBS 的机制:[27][28]
- 去极化阻滞:电流阻断神经元在电极处或电极附近的输出。
- 突触抑制:通过激活与刺激电极附近的神经元突触连接的轴突末梢,引起神经元输出的间接调节。
- 神经元异常振荡活动的去同步。
- 反向激活激活/阻滞远端神经元或阻滞慢轴突[3]。
DBS是对以往苍白球切开术(即苍白球外科消融)或丘脑切开术(即丘脑外科消融)治疗的一种进步[29]。取而代之的是,将一个带有多个电极的细导线植入苍白球、腹外侧核或丘脑下核,电脉冲用于治疗。植入物的导线延伸到胸部皮肤下的神经刺激器。
它对脑细胞和神经递质的直接影响目前还在争论中,但通过向大脑的特定区域发送高频电脉冲,它可以减轻症状[30],直接减少帕金森病药物引起的副作用[31],使药物减少,或使药物治疗方案更容易忍受。
组成和布局
DBS系统由三部分组成:植入脉冲发生器(IPG)、引线和扩展部分。IPG是一种由电池供电的神经刺激器,包裹在钛外壳中,它向大脑发送电脉冲,干扰目标部位的神经活动。铅是用聚氨酯绝缘的线圈,有四个铂铱电极,被放置在大脑的一个或两个不同的核中。引线通过一根延伸线与IPG连接,这是一根绝缘电线,在皮肤下面,从头部、颈部侧面、耳朵后面,到IPG, IPG位于锁骨下皮下,在某些情况下,是腹部[9]。IPG可以由神经科医生、护士或训练有素的技术人员校准,以优化症状抑制和控制副作用[32]。
根据需要治疗的症状类型,将DBS导联植入大脑。对于非帕金森特发性震颤,导线放置在丘脑腹中间核或内嵌带[33]; 对于肌张力障碍和与PD相关的症状(强直、运动迟缓/运动不全和震颤,导线可置于苍白球内或丘脑下核;对强迫症和抑郁症的作用是伏隔核;持续疼痛至丘脑后区或导水管周围灰质区;以及丘脑前核的癫痫治疗[34]。
这三种成分都要通过手术植入体内。铅植入可在局部麻醉或全身麻醉下进行(“睡眠DBS”),如肌张力障碍。在颅骨上钻一个直径约14毫米的孔,使用基于框架或无框架的立体定向方式将探针电极立体定向插入[35]。在局部麻醉的清醒过程中,来自人的反馈被用来确定永久电极的最佳放置位置。在睡眠过程中,利用术中MRI引导对脑组织和设备进行直接可视化[36]。IPG和延伸导线的安装是在全身麻醉下进行的[37]。刺激右脑来解决身体左侧的症状,反之亦然。
研究
慢性痛
刺激导水管周围灰质和脑室周围灰质来治疗痛觉性疼痛,刺激内囊、腹侧后外侧核和腹侧后内侧核来治疗神经性疼痛,对一些人产生了令人印象深刻的结果,但结果各不相同。一项[38]针对17名癌症顽固性疼痛患者的研究发现,其中13人几乎没有疼痛,只有4人在干预后出院时需要服用阿片类镇痛药。大多数人最终诉诸于阿片类药物,通常是在生命的最后几周[39]。DBS也被用于治疗幻肢疼痛[40]。
重度抑郁症和强迫症
DBS已在少量临床试验中用于治疗严重难治性抑郁症(TRD)患者[41]。DBS治疗TRD的神经解剖学靶点包括膝下扣带回、后直回[42]、伏隔核[43]、腹侧囊/腹侧纹状体、丘脑下蒂和外侧缰状核[41] 。最近提出的DBS干预抑郁症的靶点是内侧前脑束的上外侧支;它的刺激导致惊人的快速抗抑郁作用[44]。
DBS治疗TRD的早期试验数量较少,目前限制了最佳神经解剖学靶点的选择[41] 。证据不足以支持DBS作为抑郁症的治疗方式;然而,该手术可能是未来一种有效的治疗方式[45]。事实上,神经外科文献中已经记录了有益的结果,包括一些为重度抑郁的人提供便携式刺激器进行自我治疗的例子[46][47][48]。
一项针对TRD和OCD的系统回顾发现了23例DBS, 9例为OCD, 7例为TRD, 1例为两者。大约一半的患者确实表现出了显著的改善,而且考虑到精神病患者的年龄相对于运动障碍患者的年龄,不良事件通常微不足道[49]。在第一个随机对照研究中,DBS用于治疗以腹侧囊/腹侧纹状体区域为靶点的TRD,在16周的研究结束时,active组和sham组之间的缓解率没有显著差异[50]。然而,另一项腹侧胶囊DBS治疗TRD的随机对照研究确实表明,有效DBS(有效率为44%)和假DBS(有效率为0%)的缓解率存在显著差异)[51]。DBS治疗强迫症疗效显著,重症和难治性患者平均有效率为60%[52]。根据这些结果,美国食品和药物管理局(FDA)根据人道主义器械豁免(HDE)批准了DBS治疗顽症,要求只有在有专业资格的医院才能实施该手术。
DBS治疗TRD与抗抑郁药一样有效,有良好的反应率和缓解率,但不良反应和安全性必须得到更全面的评估。常见的副作用包括伤口感染、围手术期头痛、情绪恶化/烦躁以及自杀倾向增加[53]。
其他临床应用
DBS对肌张力障碍患者的治疗结果显示,积极效果往往在数周至数月的时间内逐渐显现,至少在某些情况下显示出功能重组的作用[54]。该方法已经在对药物有抗药性的癫痫患者身上进行了有效性测试[55]。DBS可通过程序性或反应性刺激减少或消除癫痫发作。
对精神分裂症患者的鼻中隔区域进行DBS可增强警惕性、合作性和欣快感[56] 。有嗜睡症和复杂部分性癫痫的患者也报告说,自我诱发的间隔核深部脑刺激能产生欣快感和性想法[47]。
据报道,通过深度电极对大脑进行电刺激,左侧海马体为3毫安,右侧海马体为1毫安[57]。
2015年,由神经外科医生领导的一组巴西研究人员描述了一种新技术,该技术允许同时植入电极,称为双侧立体定向术。主要的好处是花在手术上的时间更少,准确性更高[58]。
2016年,DBS被发现可以改善Rett综合征小鼠模型的学习和记忆[59]。最近2018年的研究表明,穹穴DBS上调了涉及突触功能、细胞存活和神经发生的基因[60],在解释海马回路功能的恢复方面迈出了一些第一步。
另见
- 植入大脑
- 电痉挛疗法
- 脑电图
- 神经调节(医学)
- 神经修复
- 人脑映射组织
- 响应性神经刺激疗法设备
参考文献
- ↑ 1.0 1.1 Kringelbach ML, Jenkinson N, Owen SL, Aziz TZ (August 2007). "Translational principles of deep brain stimulation". Nature Reviews. Neuroscience. 8 (8): 623–35. doi:10.1038/nrn2196. PMID 17637800. S2CID 147427108.
- ↑ Hammond C, Ammari R, Bioulac B, Garcia L (November 2008). "Latest view on the mechanism of action of deep brain stimulation" (PDF). Movement Disorders. 23 (15): 2111–21. doi:10.1002/mds.22120. PMID 18785230. S2CID 14905206.
- ↑ 3.0 3.1 García MR, Pearlmutter BA, Wellstead PE, Middleton RH (2013). "A slow axon antidromic blockade hypothesis for tremor reduction via deep brain stimulation". PLOS ONE. 8 (9): e73456. Bibcode:2013PLoSO...873456G. doi:10.1371/journal.pone.0073456. PMC 3774723. PMID 24066049.
- ↑ "FDA approves brain implant to help reduce Parkinson's disease and essential tremor symptoms". FDA. Retrieved May 23, 2016.
The first device, Medtronic’s Activa Deep Brain Stimulation Therapy System, was approved in 1997 for tremor associated with essential tremor and Parkinson’s disease.
- ↑ 'Brain pacemaker' treats dystonia. KNBC TV, April 22, 2003. Retrieved October 18, 2006.
- ↑ "Medtronic Receives FDA Approval for Deep Brain Stimulation Therapy for Medically Refractory Epilepsy". newsroom.medtronic.com. Retrieved 2018-12-18.
- ↑ "FDA Approves Humanitarian Device Exemption for Deep Brain Stimulator for Severe Obsessive-Compulsive Disorder". FDA.
- ↑ Gildenberg PL (2005). "Evolution of neuromodulation". Stereotactic and Functional Neurosurgery. 83 (2–3): 71–79. doi:10.1159/000086865. PMID 16006778. S2CID 20234898.
- ↑ 9.0 9.1 National Institute of Neurological Disorders and Stroke. Deep brain stimulation for Parkinson's disease information page Retrieved November 23, 2006.
- ↑ U.S. Department of Health and Human Services. FDA approves implanted brain stimulator to control tremors. Retrieved February 10, 2015.
- ↑ Koller, W. and Melamed, E., 2007. Parkinson's disease and related disorders. 1st ed. Edinburgh: Elsevier.
- ↑ Bronstein JM, et al. (February 2011). "Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues". Archives of Neurology. 68 (2): 165. doi:10.1001/archneurol.2010.260. PMC 4523130. PMID 20937936.
- ↑ Dallapiazza, R. F.; Vloo, P. D.; Fomenko, A.; Lee, D. J.; Hamani, C.; Munhoz, R. P.; Hodaie, M.; Lozano, A. M. et al. (2018). "Considerations for Patient and Target Selection in Deep Brain Stimulation surgery for Parkinson’s disease". In Stoker, T. B.; Greenland, J. C.. Parkinson's disease: Pathogenesis and clinical aspects. Brisbane: Codon Publications. doi:10.15586/codonpublications.parkinsonsdisease.2018.ch8. ISBN 978-0-9944381-6-4. PMID 30702838.
- ↑ 14.0 14.1 "Tourette syndrome and other tic disorders". Hyperkinetic Movement Disorders. 100. March 2005. pp. 641–57. doi:10.1016/B978-0-444-52014-2.00046-X. ISBN 9780444520142. PMID 21496613. Also see Singer HS (March 2005). "Tourette's syndrome: from behaviour to biology". The Lancet. Neurology. 4 (3): 149–59. doi:10.1016/S1474-4422(05)01012-4. PMID 15721825. S2CID 20181150.
- ↑ 15.0 15.1 Robertson MM (February 2011). "Gilles de la Tourette syndrome: the complexities of phenotype and treatment". British Journal of Hospital Medicine. 72 (2): 100–07. doi:10.12968/hmed.2011.72.2.100. PMID 21378617.
- ↑ 16.0 16.1 Du JC, Chiu TF, Lee KM, Wu HL, Yang YC, Hsu SY, Sun CS, Hwang B, Leckman JF (October 2010). "Tourette syndrome in children: an updated review". Pediatrics and Neonatology. 51 (5): 255–64. doi:10.1016/S1875-9572(10)60050-2. PMID 20951354.
- ↑ Tourette Syndrome Association. Statement: Deep Brain Stimulation and Tourette Syndrome. Retrieved November 22, 2005.
- ↑ 18.0 18.1 18.2 Malone DA, Pandya MM (2006). "Behavioral neurosurgery". Advances in Neurology. 99: 241–47. PMID 16536372.
- ↑ Mink JW, Walkup J, Frey KA, Como P, Cath D, Delong MR, Erenberg G, Jankovic J, Juncos J, Leckman JF, Swerdlow N, Visser-Vandewalle V, Vitek JL (November 2006). "Patient selection and assessment recommendations for deep brain stimulation in Tourette syndrome" (PDF). Movement Disorders. 21 (11): 1831–38. doi:10.1002/mds.21039. hdl:2027.42/55891. PMID 16991144. S2CID 16353255.
- ↑ Viswanathan A, Jimenez-Shahed J, Baizabal Carvallo JF, Jankovic J (2012). "Deep brain stimulation for Tourette syndrome: target selection". Stereotactic and Functional Neurosurgery. 90 (4): 213–24. doi:10.1159/000337776. PMID 22699684.
- ↑ Doshi PK (April 2011). "Long-term surgical and hardware-related complications of deep brain stimulation". Stereotactic and Functional Neurosurgery. 89 (2): 89–95. doi:10.1159/000323372. PMID 21293168. S2CID 10553177.
- ↑ Scangos, K.W., Makhoul, G.S., Sugrue, L.P. (2021). "State-dependent responses to intracranial brain stimulation in a patient with depression". Nat Med. 27 (2): 229–231. doi:10.1038/s41591-020-01175-8. ISSN 1078-8956. PMC 8284979. PMID 33462446.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Burn DJ, Tröster AI (September 2004). "Neuropsychiatric complications of medical and surgical therapies for Parkinson's disease". Journal of Geriatric Psychiatry and Neurology. 17 (3): 172–80. doi:10.1177/0891988704267466. PMID 15312281.
- ↑ "Deep Brain Stimulation May Put Parkinson's Patients at Risk for Drowning". www.medpagetoday.com (in English). 2019-11-27. Retrieved 2019-12-09.
- ↑ Bangash, Omar K.; Thorburn, Megan; Garcia-Vega, Jimena; Walters, Susan; Stell, Rick; Starkstein, Sergio E.; Lind, Christopher R. P. (May 2016). "Drowning hazard with deep brain stimulation: case report". Journal of Neurosurgery. 124 (5): 1513–16. doi:10.3171/2015.5.JNS15589. ISSN 1933-0693. PMID 26566200.
- ↑ Mogilner A.Y.; Benabid A.L.; Rezai A.R. (2004). "Chronic Therapeutic Brain Stimulation: History, Current Clinical Indications, and Future Prospects". Bioelectromagnetic medicine. New York: Marcel Dekker. pp. 133–51. ISBN 978-0-8247-4700-8.
- ↑ McIntyre CC, Thakor NV (2002). "Uncovering the mechanisms of deep brain stimulation for Parkinson's disease through functional imaging, neural recording, and neural modeling". Critical Reviews in Biomedical Engineering. 30 (4–6): 249–81. doi:10.1615/critrevbiomedeng.v30.i456.20. PMID 12739751.
- ↑ Herrington TM, Cheng JJ, Eskandar EN (January 2016). "Mechanisms of deep brain stimulation". Journal of Neurophysiology. 115 (1): 19–38. doi:10.1152/jn.00281.2015. PMC 4760496. PMID 26510756.
- ↑ Machado A, Rezai AR, Kopell BH, Gross RE, Sharan AD, Benabid AL (June 2006). "Deep brain stimulation for Parkinson's disease: surgical technique and perioperative management". Movement Disorders. 21 Suppl 14 (Suppl 14): S247–58. doi:10.1002/mds.20959. PMID 16810722. S2CID 18194178.
- ↑ Moro E, Lang AE (November 2006). "Criteria for deep-brain stimulation in Parkinson's disease: review and analysis". Expert Review of Neurotherapeutics. 6 (11): 1695–705. doi:10.1586/14737175.6.11.1695. PMID 17144783. S2CID 20857769.
- ↑ Apetauerova D, Ryan RK, Ro SI, Arle J, Shils J, Papavassiliou E, Tarsy D (August 2006). "End of day dyskinesia in advanced Parkinson's disease can be eliminated by bilateral subthalamic nucleus or globus pallidus deep brain stimulation". Movement Disorders. 21 (8): 1277–79. doi:10.1002/mds.20896. PMID 16637040. S2CID 42122286.
- ↑ Volkmann J, Herzog J, Kopper F, Deuschl G (2002). "Introduction to the programming of deep brain stimulators". Movement Disorders. 17 Suppl 3: S181–87. doi:10.1002/mds.10162. PMID 11948775. S2CID 21988668.
- ↑ Lee JY, Deogaonkar M, Rezai A (July 2007). "Deep brain stimulation of globus pallidus internus for dystonia". Parkinsonism & Related Disorders. 13 (5): 261–65. doi:10.1016/j.parkreldis.2006.07.020. PMID 17081796.
- ↑ Deep brain stimulation. Surgery Encyclopedia. Retrieved January 25, 2007.
- ↑ Owen CM, Lindsey ME (May 2009). "Frame-based stereotaxy in a frameless era: current capabilities, relative role, and the positive- and negative predictive values of blood through the needle". Journal of Neuro-Oncology. 93 (1): 139–49. doi:10.1007/s11060-009-9871-y. PMID 19430891.
- ↑ Starr PA, Martin AJ, Ostrem JL, Talke P, Levesque N, Larson PS (March 2010). "Subthalamic nucleus deep brain stimulator placement using high-field interventional magnetic resonance imaging and a skull-mounted aiming device: technique and application accuracy". Journal of Neurosurgery. 112 (3): 479–90. doi:10.3171/2009.6.JNS081161. PMC 2866526. PMID 19681683.
- ↑ Deep Brain Stimulation, Department of Neurological Surgery, University of Pittsburgh. Retrieved May 13, 2008.
- ↑ Young RF & Brechner T (1986). "Electrical stimulation of the brain for relief of intractable pain due to cancer". Cancer. 57 (6): 1266–72. doi:10.1002/1097-0142(19860315)57:6<1266::aid-cncr2820570634>3.0.co;2-q. PMID 3484665.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Johnson MI, Oxberry SG & Robb K (2008). "Stimulation-induced analgesia". In Sykes N, Bennett MI & Yuan C-S. Clinical pain management: Cancer pain (2nd ed.). London: Hodder Arnold. pp. 235–50. ISBN 978-0-340-94007-5.
- ↑ Kringelbach ML, Jenkinson N, Green AL, Owen SL, Hansen PC, Cornelissen PL, Holliday IE, Stein J, Aziz TZ (February 2007). "Deep brain stimulation for chronic pain investigated with magnetoencephalography". NeuroReport. 18 (3): 223–28. CiteSeerX 10.1.1.511.2667. doi:10.1097/wnr.0b013e328010dc3d. PMID 17314661. S2CID 7091307.
- ↑ 41.0 41.1 41.2 Anderson RJ, Frye MA, Abulseoud OA, Lee KH, McGillivray JA, Berk M, Tye SJ (September 2012). "Deep brain stimulation for treatment-resistant depression: efficacy, safety and mechanisms of action". Neuroscience and Biobehavioral Reviews. 36 (8): 1920–33. doi:10.1016/j.neubiorev.2012.06.001. PMID 22721950. S2CID 207089716.
- ↑ Accolla EA, Aust S, Merkl A, Schneider GH, Kühn AA, Bajbouj M, Draganski B (April 2016). "Deep brain stimulation of the posterior gyrus rectus region for treatment resistant depression". Journal of Affective Disorders. 194: 33–37. doi:10.1016/j.jad.2016.01.022. PMID 26802505.
- ↑ Schlaepfer TE, Cohen MX, Frick C, Kosel M, Brodesser D, Axmacher N, Joe AY, Kreft M, Lenartz D, Sturm V (January 2008). "Deep brain stimulation to reward circuitry alleviates anhedonia in refractory major depression". Neuropsychopharmacology. 33 (2): 368–77. doi:10.1038/sj.npp.1301408. PMID 17429407.
- ↑ Schlaepfer TE, Bewernick BH, Kayser S, Mädler B, Coenen VA (June 2013). "Rapid effects of deep brain stimulation for treatment-resistant major depression". Biological Psychiatry. 73 (12): 1204–12. doi:10.1016/j.biopsych.2013.01.034. PMID 23562618. S2CID 6374368.
- ↑ Murphy, Destiny N.; Boggio, Paulo; Fregni, Felipe (2009). "Transcranial direct current stimulation as a therapeutic tool for the treatment of major depression: insights from past and recent clinical studies". Curr Opin Psychiatry. 22 (3): 306–11. doi:10.1097/YCO.0b013e32832a133f. PMID 19339889. S2CID 11392351.
- ↑ Delgado, Jose (1986). Physical Control of the Mind: Toward a Psychocivilized Society. New York: Harper and Row. ISBN 0-06-131914-7.
- ↑ 47.0 47.1 Faria MA (2013). "Violence, mental illness, and the brain – A brief history of psychosurgery: Part 3 – From deep brain stimulation to amygdalotomy for violent behavior, seizures, and pathological aggression in humans". Surgical Neurology International. 4 (1): 91. doi:10.4103/2152-7806.115162. PMC 3740620. PMID 23956934.
- ↑ Robison RA, Taghva A, Liu CY, Apuzzo ML (2012). "Surgery of the mind, mood, and conscious state: an idea in evolution". World Neurosurgery. 77 (5–6): 662–86. doi:10.1016/j.wneu.2012.03.005. PMID 22446082.
- ↑ Lakhan SE, Callaway E (March 2010). "Deep brain stimulation for obsessive-compulsive disorder and treatment-resistant depression: systematic review". BMC Research Notes. 3 (1): 60. doi:10.1186/1756-0500-3-60. PMC 2838907. PMID 20202203.
- ↑ Dougherty DD, Rezai AR, Carpenter LL, Howland RH, Bhati MT, O'Reardon JP, Eskandar EN, Baltuch GH, Machado AD, Kondziolka D, Cusin C, Evans KC, Price LH, Jacobs K, Pandya M, Denko T, Tyrka AR, Brelje T, Deckersbach T, Kubu C, Malone DA (August 2015). "A Randomized Sham-Controlled Trial of Deep Brain Stimulation of the Ventral Capsule/Ventral Striatum for Chronic Treatment-Resistant Depression". Biological Psychiatry. 78 (4): 240–48. doi:10.1016/j.biopsych.2014.11.023. PMID 25726497. S2CID 22644265.
- ↑ Bergfeld IO, Mantione M, Hoogendoorn ML, Ruhé HG, Notten P, van Laarhoven J, et al. (May 2016). "Deep Brain Stimulation of the Ventral Anterior Limb of the Internal Capsule for Treatment-Resistant Depression: A Randomized Clinical Trial". JAMA Psychiatry. 73 (5): 456–64. doi:10.1001/jamapsychiatry.2016.0152. PMID 27049915.
- ↑ Alonso P, Cuadras D, Gabriëls L, Denys D, Goodman W, Greenberg BD, et al. (2015-07-24). "Deep Brain Stimulation for Obsessive-Compulsive Disorder: A Meta-Analysis of Treatment Outcome and Predictors of Response". PLOS ONE. 10 (7): e0133591. Bibcode:2015PLoSO..1033591A. doi:10.1371/journal.pone.0133591. PMC 4514753. PMID 26208305.
- ↑ Moreines JL, McClintock SM, Holtzheimer PE (January 2011). "Neuropsychologic effects of neuromodulation techniques for treatment-resistant depression: a review". Brain Stimulation. 4 (1): 17–27. doi:10.1016/j.brs.2010.01.005. PMC 3023999. PMID 21255751.
- ↑ Krauss JK (2002). "Deep brain stimulation for dystonia in adults. Overview and developments". Stereotactic and Functional Neurosurgery. 78 (3–4): 168–82. doi:10.1159/000068963. PMID 12652041. S2CID 71888143.
- ↑ Wu C, Sharan AD (Jan–Feb 2013). "Neurostimulation for the treatment of epilepsy: a review of current surgical interventions". Neuromodulation. 16 (1): 10–24, discussion 24. doi:10.1111/j.1525-1403.2012.00501.x. PMID 22947069. S2CID 1711587.
- ↑ Heath RG (January 1972). "Pleasure and brain activity in man. Deep and surface electroencephalograms during orgasm". The Journal of Nervous and Mental Disease. 154 (1): 3–18. doi:10.1097/00005053-197201000-00002. PMID 5007439. S2CID 136706.
- ↑ Surbeck W, Bouthillier A, Nguyen DK (2013). "Bilateral cortical representation of orgasmic ecstasy localized by depth electrodes". Epilepsy & Behavior Case Reports. 1: 62–65. doi:10.1016/j.ebcr.2013.03.002. PMC 4150648. PMID 25667829.
- ↑ Fonoff ET, Azevedo A, Angelos JS, Martinez RC, Navarro J, Reis PR, Sepulveda ME, Cury RG, Ghilardi MG, Teixeira MJ, Lopez WO (July 2016). "Simultaneous bilateral stereotactic procedure for deep brain stimulation implants: a significant step for reducing operation time". Journal of Neurosurgery. 125 (1): 85–89. doi:10.3171/2015.7.JNS151026. PMID 26684776.
- ↑ Lu H, Ash RT, He L, Kee SE, Wang W, Yu D, Hao S, Meng X, Ure K, Ito-Ishida A, Tang B, Sun Y, Ji D, Tang J, Arenkiel BR, Smirnakis SM, Zoghbi HY (August 2016). "Loss and Gain of MeCP2 Cause Similar Hippocampal Circuit Dysfunction that Is Rescued by Deep Brain Stimulation in a Rett Syndrome Mouse Model". Neuron. 91 (4): 739–47. doi:10.1016/j.neuron.2016.07.018. PMC 5019177. PMID 27499081.
- ↑ Pohodich AE, Yalamanchili H, Raman AT, Wan YW, Gundry M, Hao S, Jin H, Tang J, Liu Z, Zoghbi HY (March 2018). "Forniceal deep brain stimulation induces gene expression and splicing changes that promote neurogenesis and plasticity". eLife. 7. doi:10.7554/elife.34031. PMC 5906096. PMID 29570050.
延伸阅读
- Appleby BS, Duggan PS, Regenberg A, Rabins PV (September 2007). "Psychiatric and neuropsychiatric adverse events associated with deep brain stimulation: A meta-analysis of ten years' experience". Movement Disorders. 22 (12): 1722–8. doi:10.1002/mds.21551. PMID 17721929. S2CID 22925963.
- Schlaepfer TE, Bewernick BH, Kayser S, Hurlemann R, Coenen VA (May 2014). "Deep brain stimulation of the human reward system for major depression--rationale, outcomes and outlook". Neuropsychopharmacology. 39 (6): 1303–14. doi:10.1038/npp.2014.28. PMC 3988559. PMID 24513970.
- Diamond A, Shahed J, Azher S, Dat-Vuong K, Jankovic J (May 2006). "Globus pallidus deep brain stimulation in dystonia". Movement Disorders. 21 (5): 692–5. doi:10.1002/mds.20767. PMID 16342255. S2CID 29677149.
- "Deep Brain Stimulation for Parkinson's Disease in Movement Disorders". Bioelectromagnetic medicine. New York, N.Y: Marcel Dekker. 2004. pp. 265–76. ISBN 978-0-8247-4700-8.
外部链接
编者推荐
课程推荐
复杂系统与脑科学
本小型研讨会希望把活跃在复杂脑系统研究的年轻学者聚在一起对数据采集、分析及网络结构和动力学建模等展开深入探讨,并讨论开展合作的可能性和前沿研究课题。
圆桌论坛:神经动力学在脑重大疾病中的临床应用--以癫痫为例
癫痫发作是高同步、高波幅的病理性神经活动,具有复杂的时间-空间演化模式,并且难以预测、难以干预。同时,人类癫痫发作的机制并不明确,因此为我们的研究带来了很多困难。前人对癫痫发作的动力学性质研究发现:即使癫痫发作电生理信号表现出高同步性,相比于正常背景活动(更多地表现出随机性),癫痫发作的动力学性质或许存在系统变化。动力学系统的稳定性分析或可更好地刻画癫痫发作前或发作中的系统性质变化,并通过维护或破坏系统稳定性,提供外科干预、神经调控与发作预测策略。本期读书会将系统研读多篇临床数据与神经动力学结合的文章(详见参考文献),并邀请神经动力学与临床研究领域的多位老师,通过圆桌讨论的方式,深入探讨如何更好地将动力学分析与临床数据相结合,怎样避免可能存在的陷阱与问题,有哪些前人的经验与教训我们可以从中吸取。
圆桌论坛:网络控制及其在神经调控中的应用
本期读书会,围绕长期神经调控对治疗效果的影响、实现精确神经调控的建模以及寻找神经系统疾病生物标记物等科学问题展开讨论。结合相关文献讨论:1)响应性神经刺激设备在局灶性癫痫疾病长期治疗的脑网络重组(reorganization);2)从系统辨识的角度实现电刺激过程中大规模脑网络动态响应建模及预测
本中文词条神经动力学读书会词条梳理志愿者喵喵子翻译审校,薄荷编辑,如有问题,欢迎在讨论页面留言。
本词条内容源自wikipedia及公开资料,遵守 CC3.0协议。