突触
在神经系统中,神经元(即神经细胞)通过称为突触[1] 的结构,将电信号或化学信号传递给其他神经元或效应靶细胞。
突触对于神经冲动在神经元之间传递是至关重要的。神经元是特化的向靶细胞传递信号的细胞,突触正是它们传递信号的手段。在突触处,传递信号的神经元(突触前神经元)与目标细胞(突触后细胞)的质膜紧密相对。突触前和突触后位点都包含大量的分子结构阵列,这些分子结构连接两个膜并执行信号传导过程[2] 。在许多突触中,突触前部分位于轴突,突触后部分位于树突或胞体上。星形胶质细胞也与突触神经元交换信息,对突触活动做出反应,从而调节神经传导。突触前和突触后神经元的突触粘附分子(SAMs)部分重叠而粘附在一起,将突触(至少化学突触)稳定在其位置;SAMs 也可能有助于突触的产生与功能[3]。
一些作者将突触的概念进行了扩展,以包括从神经元到任何其他细胞类型,比如到运动细胞(尽管这种非神经元的接触可能被称为接头,一个有些历史的术语)的通讯[4] 。Sanford Palay 的一项具有里程碑意义的研究证明了突触的存在[5]。
概念的历史
Santiago Ramón y Cajal 提出身体内的神经元之间并不是连续的,但仍然相互交流,即所谓的神经元学说[6] 。突触的英文单词(synapse)是由英国神经生理学家 Charles Sherrington 于1897年在迈克尔 · 福斯特的《生理学教科书》中引入的 [1] 。Sherrington 想找个好用的名词,以突出两个独立单元之间的结合,而实际上“synapse”一词是由福斯特的朋友、英国古典学者 Arthur Woollgar Verrall 提议的 [7][8] 。这个词来源于希腊语 synapsis,意指“连接”,它又来源于“together”和“ to fasten”。
突触间隙当时作为理论上的构造,有被表述为轴突末端与树突或胞体之间的不连续性。但这种突触前后膜的分离,现在我们知道约有 20 纳米,用当时最好的光学显微镜进行组织学观察是无法分辨的。直到 20 世纪 50 年代,用电子显微镜才显示了突触的精细结构,突触前和突触后分离的、平行的细胞膜与突起,以及两者之间的间隙[9][10]。
化学突触和电突触
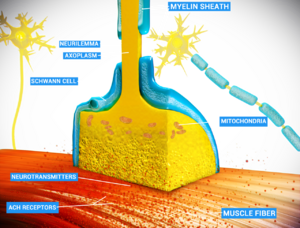
存在两种完全不同类型的突触:
- 在化学突触,突触前神经元的电活动(通过激活电压门控钙通道)被转化为称为神经递质的化学物质的释放。神经递质可与位于突触后膜上的受体结合,从而引起电反应,或通过第二信使通路激发或抑制突触后神经元。化学突触可以根据所释放的神经递质进行分类: 谷氨酸能(通常是兴奋性的)、GABA能(通常是抑制性的)、胆碱能(比如,脊椎动物神经肌肉接头)和肾上腺素能(释放去甲肾上腺素)。由于受体信号转导的复杂性,化学突触可以对突触后细胞产生复杂的效应。
- 电突触,突触前、后的细胞膜通过特殊的称为缝隙连接的通道连接。这些通道允许电流通过,使得突触前细胞的电压变化能引起突触后细胞的电位变化。电突触的主要优点是细胞间的信号传递是极快的[11]。
不同于突触通信,假突触耦合允许神经元之间通过间接的电场进行通信。
自突触是一类化学突触或电突触,神经元的轴突会与自身的树突形成突触。
接合类型
突触可以按构成突触前和突触后的神经元部位进行分类。哺乳动物神经系统中的绝大多数突触是经典的轴树突触(轴突到树突的突触) ,然而存在其它的排列方式,包括但不限于轴轴突触、树树突触、轴分泌突触、体树突触、树体突触和体体突触。
轴突跨突触释放神经递质于树突、胞体、其他轴突或轴突末梢,也可以进入血流或扩散到邻近的神经组织。
记忆中的作用
突触在记忆形成中的重要作用已获广泛的认可。当神经递质跨突触间隙后激活受体时,突触前后的两个神经元如果是同时发生活跃时,两者之间的连接就会加强,这是受体信号通路机制产生的结果。两个神经通路之间的连接强度可以存储信息,从而产生了记忆。这种突触强化的过程被称为长时程增强[12]。
突触的可塑性可以通过改变神经递质释放,从而在突触前细胞中进行控制;也可以通过改变细胞膜上受体的数量和功能,在突触后细胞进行调节。突触后信号的改变,多与突触后细胞钙内流引起的 N-甲基-D-天冬氨酸受体(NMDAR)依赖的长时程增强(long-term potentiation, LTP)和长时程抑制(long-term depression, LTD)有关。LTP 和 LTD 是研究最多的兴奋性突触可塑性形式[13]。
研究模型
因技术原因,历史上对突触结构和功能的研究都是在较大的突触模型上进行的,例如:
- 乌贼的巨突触
- 神经肌肉接头,在脊椎动物是胆碱能,昆虫中是谷氨酸能
- 鸡的睫状神经节的睫状体萼[14]
- 视网膜的带突触,
- 海马的 Schaffer 侧枝突触
突触极性
神经元的功能依赖于细胞极性。神经细胞独特的结构使得动作电位可以单向传递(从树突到细胞体再到轴突) ,这些信号可以被突触后神经元接收和传递,或者被效应细胞接收。长期以来,神经细胞一直被用作细胞极性的模型,尤其用来研究突触分子极性定位的机制。受肌醇单磷酸酶(IMPase) 调节的 PIP2 信号通路在突触极性中起着重要作用。
磷脂酰肌醇(PIP、PIP2 和 PIP3)已被证明是影响神经元极性的分子[15] 。在秀丽线虫中鉴定的基因 ttx-7,编码 IMPase——一种使磷酸肌醇脱磷酸化产生肌醇的酶。ttx-7 基因突变的线虫表现出行为和蛋白定位缺陷,而这些缺陷是通过表达 IMPase 而恢复。这些可以得出,IMPase 对突触组成蛋白的正确定位是必要的[16][17] 。Egl-8 基因编码磷脂酶 Cβ(PLCβ)的同源基因。当 ttx-7 突变体也发生 egl-8 基因突变时,由 ttx-7 基因突变导致的的缺陷表型可以很大程度被逆转。这些结果表明,PIP2 信号通路建立了神经元中突触组成蛋白的极性定位.[16]。
突触前调制
通过 G 蛋白偶联受体(GPCR)对神经递质释放进行调节是突触传递的主要突触前机制。GPCR 位于突触前末端,激活 GPCRs 可以降低神经递质释放的概率。这种突触前抑制涉及 Gi/o 型的 G 蛋白的激活,介导不同的抑制机制,包括抑制电压门控钙离子通道、激活钾离子通道,或直接抑制囊泡融合过程。一个例子是内源性大麻素,其在突触后神经元合成和释放,通过逆向信号通路(突触后神经元合成与释放的分子反向作用到突触前末梢),作用于突触前膜的同源受体,比如 CB1 受体,引起短期(STD)或长期的突触抑制(LTD),导致短期或长期神经递质释放减少[18]。
参考文献
- ↑ 1.0 1.1 Foster, M.; Sherrington, C.S. (1897). Textbook of Physiology, volume 3 (7th ed.). London: Macmillan. p. 929.
- ↑ Perea, G.; Navarrete, M.; Araque, A. (August 2009). "Tripartite synapses: astrocytes process and control synaptic information". Trends in Neurosciences. Cambridge, MA: Cell Press. 32 (8): 421–431. doi:10.1016/j.tins.2009.05.001. PMID 19615761. S2CID 16355401.
- ↑ Missler, M; Südhof, TC; Biederer, T (2012). "Synaptic cell adhesion". Cold Spring Harb Perspect Biol. 4 (4): a005694. doi:10.1101/cshperspect.a005694. PMC 3312681. PMID 22278667.
- ↑ Schacter, Daniel L.; Gilbert, Daniel T.; Wegner, Daniel M. (2011). Psychology (2nd ed.). New York: Worth Publishers. p. 80. ISBN 978-1-4292-3719-2. LCCN 2010940234. OCLC 696604625. https://archive.org/details/psychology0000scha.
- ↑ Palay, Sanford (1956). "Synapses in the central nervous system". J Biophys Biochem Cytol. 2 (4): 193–202. doi:10.1083/jcb.2.4.193. PMC 2229686. PMID 13357542.
- ↑ Elias, Lorin J.; Saucier, Deborah M. (2006). Neuropsychology: Clinical and Experimental Foundations. Boston: Pearson/Allyn & Bacon. ISBN 978-0-20534361-4. LCCN 2005051341. OCLC 61131869.
- ↑ "synapse". Online Etymology Dictionary. Archived from the original on 2013-12-14. Retrieved 2013-10-01.
- ↑ Tansey, E.M. (1997). "Not committing barbarisms: Sherrington and the synapse, 1897". Brain Research Bulletin. Amsterdam: Elsevier. 44 (3): 211–212. doi:10.1016/S0361-9230(97)00312-2. PMID 9323432. S2CID 40333336.
The word synapse first appeared in 1897, in the seventh edition of Michael Foster's Textbook of Physiology.
- ↑ De Robertis, Eduardo D.P.; Bennett, H. Stanley (1955). "Some features of the submicroscopic morphology of synapses in frog and earthworm" (PDF). Journal of Biophysical and Biochemical Cytology. 1 (1): 47–58. doi:10.1083/jcb.1.1.47. PMC 2223594.
- ↑ Palay, Sanford L.; Palade, George E. (1955). "The fine structure of neurons" (PDF). Journal of Biophysical and Biochemical Cytology. 1 (1): 69–88. doi:10.1083/jcb.1.1.69. PMC 2223597.
- ↑ Silverthorn, Dee Unglaub (2007). Human Physiology: An Integrated Approach. Illustration coordinator William C. Ober; illustrations by Claire W. Garrison; clinical consultant Andrew C. Silverthorn; contributions by Bruce R. Johnson (4th ed.). San Francisco: Pearson/Benjamin Cummings. p. 271. ISBN 978-0-8053-6851-2. LCCN 2005056517. OCLC 62742632.
- ↑ Lynch, M. A. (January 1, 2004). "Long-Term Potentiation and Memory". Physiological Reviews. 84 (1): 87–136. doi:10.1152/physrev.00014.2003. PMID 14715912.
- ↑ Krugers, Harm J.; Zhou, Ming; Joëls, Marian; Kindt, Merel (October 11, 2011). "Regulation of Excitatory Synapses and Fearful Memories by Stress Hormones". Frontiers in Behavioral Neuroscience. Switzerland: Frontiers Media SA. 5: 62. doi:10.3389/fnbeh.2011.00062. PMC 3190121. PMID 22013419.
- ↑ Stanley, EF (1992). "The calyx-type synapse of the chick ciliary ganglion as a model of fast cholinergic transmission". Canadian Journal of Physiology and Pharmacology. 70 Suppl: S73-7. doi:10.1139/y92-246. PMID 1338300.
- ↑ Arimura, Nariko; Kaibuchi, Kozo (December 22, 2005). "Key regulators in neuronal polarity". Neuron. Cambridge, MA: Cell Press. 48 (6): 881–884. doi:10.1016/j.neuron.2005.11.007. PMID 16364893.
- ↑ 16.0 16.1 Kimata, Tsubasa; Tanizawa, Yoshinori; Can, Yoko; et al. (June 1, 2012). "Synaptic Polarity Depends on Phosphatidylinositol Signaling Regulated by myo-Inositol Monophosphatase in Caenorhabditis elegans". Genetics. Bethesda, MD: Genetics Society of America. 191 (2): 509–521. doi:10.1534/genetics.111.137844. PMC 3374314. PMID 22446320.
- ↑ Tanizawa, Yoshinori; Kuhara, Atsushi; Inada, Hitoshi; et al. (December 1, 2006). "Inositol monophosphatase regulates localization of synaptic components and behavior in the mature nervous system of C. elegans". Genes & Development. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. 20 (23): 3296–3310. doi:10.1101/gad.1497806. PMC 1686606. PMID 17158747.
- ↑ Lovinger, David M. (2008), "Presynaptic Modulation by Endocannabinoids", in Südhof, Thomas C.; Starke, Klaus (eds.), Pharmacology of Neurotransmitter Release, Handbook of Experimental Pharmacology (in English), vol. 184, Springer Berlin Heidelberg, pp. 435–477, doi:10.1007/978-3-540-74805-2_14, ISBN 9783540748052, PMID 18064422
编辑推荐
课程推荐
神经动力学模型读书会
人类大脑是一个由数以百亿计的神经元相互连接所构成的复杂系统。自神经科学这一学科建立以来,从解析神经元之间的相互作用机理、到刻画皮层柱之间的连接形式、再到探究脑区间不同认知功能的分离与整合模式,无数科学家试图从不同尺度研究大脑,以期揭示人脑这一最为复杂的神经系统的工作模式,进而理解语言、情绪、记忆和社会交往等高级认知活动的底层神经机制,并一定程度上启发通用人工智能机器人的设计。
近年来,脱胎于系统科学的动力学建模方法,逐渐被广泛地应用于神经科学研究中,其作为一种绝佳的数理工具,愈发地受到研究人员的重视,在类脑计算、脑认知原理解析和脑重大疾病致病机理探索等具体方面,发挥着不可替代的作用。
本着促进神经科学、系统科学以及计算机科学等不同领域的学术工作者的交流与合作,激发有志于加入脑科学与类脑研究这一领域的同学们的研究兴趣,来自国内外多所知名高校的专家学者(详见发起人介绍)共同发起了「神经动力学模型」读书会,聚焦于神经科学中的动力学建模这一前沿课题,讨论他们在研究一线中遇到的实际困惑,对相关文献进行深入梳理、激发跨学科的学术火花。
李印赟:神经突触可塑性微观机制及神经环路研究
该讲座分为两部分:第一部分为神经元的轴突输运特征及其与神经形态之间的关系,第二部分为神经突触可塑性中涉及的囊泡输运和释放,短时突触可塑性的神经细胞差异性及其在神经元微环路中细胞发放特征的作用。
文章推荐
本中文词条由周昌松老师提供,由神经动力学模型读书会词条梳理志愿者 okxy 翻译审校,薄荷编辑,如有问题,欢迎在讨论页面留言。
本词条内容源自wikipedia及公开资料,遵守 CC3.0协议。