“神经元”的版本间的差异
(→连接性) |
(→连接性) |
||
| 第188行: | 第188行: | ||
==连接性== | ==连接性== | ||
[[File:Chemical synapse schema cropped.jpg|thumb|right|350px|沿着轴突传播到下一个细胞的细胞体和树突的一种信号。]] | [[File:Chemical synapse schema cropped.jpg|thumb|right|350px|沿着轴突传播到下一个细胞的细胞体和树突的一种信号。]] | ||
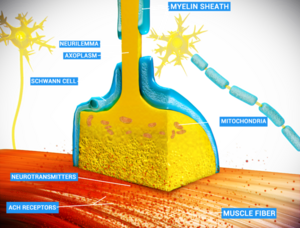
| − | [[File: | + | [[File:Neuro_Muscular_Junction2.png|thumb|化学突触|left]] |
神经元通过突触相互沟通,一个细胞的轴突终端接触到另一个神经元的树突、胞体,或者更少见的轴突。像小脑中的浦肯野细胞这样的神经元可以有超过1000个树突分支,与成千上万的其他细胞建立连接; 其他的神经元,如视上核的大细胞神经元,只有一个或两个树突,每个树突接收数千个突触。 | 神经元通过突触相互沟通,一个细胞的轴突终端接触到另一个神经元的树突、胞体,或者更少见的轴突。像小脑中的浦肯野细胞这样的神经元可以有超过1000个树突分支,与成千上万的其他细胞建立连接; 其他的神经元,如视上核的大细胞神经元,只有一个或两个树突,每个树突接收数千个突触。 | ||
| 第201行: | 第201行: | ||
自突触是指神经元的轴突与自己的树突相连的突触。 | 自突触是指神经元的轴突与自己的树突相连的突触。 | ||
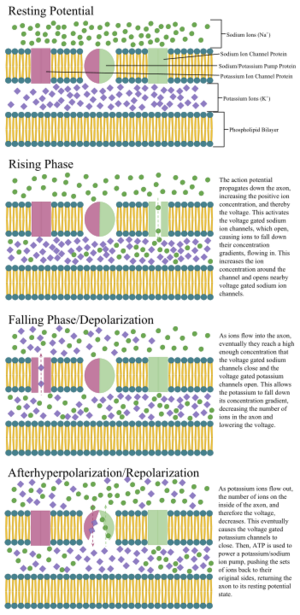
| − | [[File: | + | [[File:Axon_Propagation2.svg.png|thumb|一个动作电位沿轴突传播的阶段的注释图,包括离子浓度和泵及通道蛋白的作用。]] |
人脑有大约8.6 x 10<sup>10</sup>(86亿)个神经元。<ref>{{ cite journal | vauthors = Herculano-Houzel S | title = The human brain in numbers: a linearly scaled-up primate brain | journal = Frontiers in Human Neuroscience | volume = 3 | pages = 31 | date = November 2009 | pmid = 19915731 | doi = 10.3389/neuro.09.031.2009 | pmc = 2776484 | doi-access = free }}</ref>每个神经元平均有7000个与其他神经元的突触连接。据估计,一个三岁孩子的大脑大约有1015个突触(1万亿)。这个数字随着年龄的增长而下降,到成年后趋于稳定。对成年人的估计有所不同,从10<sup>14</sup> 到 5 x 10<sup>14</sup>个突触(100到500万亿)不等。<ref>{{cite journal | vauthors = Drachman DA | title = Do we have brain to spare? | journal = Neurology | volume = 64 | issue = 12 | pages = 2004–5 | date = June 2005 | pmid = 15985565 | doi = 10.1212/01.WNL.0000166914.38327.BB }}</ref> | 人脑有大约8.6 x 10<sup>10</sup>(86亿)个神经元。<ref>{{ cite journal | vauthors = Herculano-Houzel S | title = The human brain in numbers: a linearly scaled-up primate brain | journal = Frontiers in Human Neuroscience | volume = 3 | pages = 31 | date = November 2009 | pmid = 19915731 | doi = 10.3389/neuro.09.031.2009 | pmc = 2776484 | doi-access = free }}</ref>每个神经元平均有7000个与其他神经元的突触连接。据估计,一个三岁孩子的大脑大约有1015个突触(1万亿)。这个数字随着年龄的增长而下降,到成年后趋于稳定。对成年人的估计有所不同,从10<sup>14</sup> 到 5 x 10<sup>14</sup>个突触(100到500万亿)不等。<ref>{{cite journal | vauthors = Drachman DA | title = Do we have brain to spare? | journal = Neurology | volume = 64 | issue = 12 | pages = 2004–5 | date = June 2005 | pmid = 15985565 | doi = 10.1212/01.WNL.0000166914.38327.BB }}</ref> | ||
2022年5月8日 (日) 13:53的版本
神经元 neuron或神经细胞 nerve cell是一种可电兴奋的细胞,通过称为突触的专门连接与其他细胞进行交流。神经元是所有动物神经组织的主要组成部分,除了海绵动物门和扁盘动物门。植物和真菌没有神经细胞。
神经元通常根据其功能被分为三种类型。感觉神经元对影响感觉器官细胞的刺激,如触摸、声音或光线作出反应,并向脊髓或大脑发送信号。运动神经元接收来自大脑和脊髓的信号,控制从肌肉收缩到腺体输出的一切。中间神经元将神经元与大脑或脊髓同一区域内的其他神经元连接起来。当多个神经元连接在一起时,它们形成所谓的神经回路。
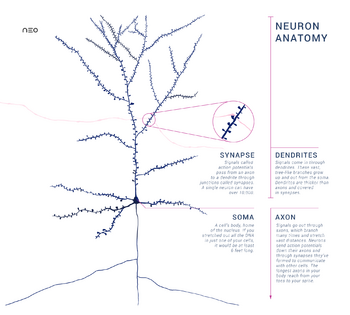
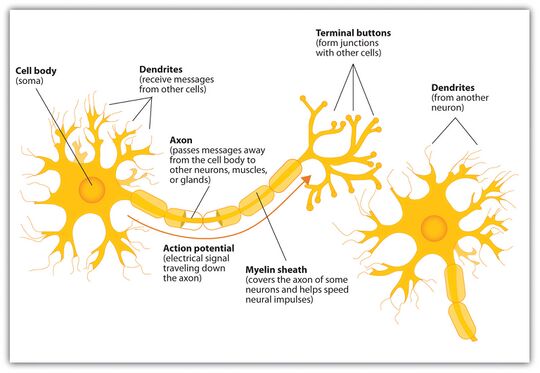
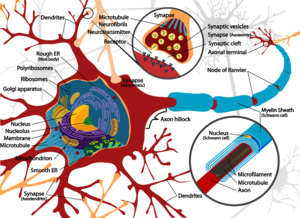
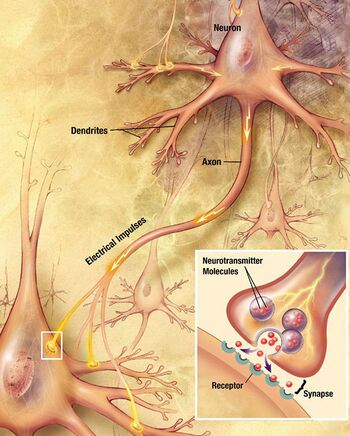
一个典型的神经元由一个细胞体 soma、树突 dendrite和一个轴突 axon组成。胞体是一个紧凑的结构,轴突和树突是从胞体中挤出的丝状物。树突通常有大量的分支,并从胞体中延伸出几百微米。轴突在一个称为轴突丘的肿胀处离开胞体,在人类中最远可达1米,在其他物种中则更远。它有分支,但通常保持一个恒定的直径。在轴突分支的最远端是轴突终端,在那里神经元可以通过突触向另一个细胞传递信号。神经元可能缺乏树突或没有轴突。术语神经突被用来描述树突或轴突,特别是当细胞未分化时。
大多数神经元通过树突和胞体接收信号,并沿轴突发出信号。在大多数突触中,信号从一个神经元的轴突交叉到另一个神经元的树突。然而,突触可以将一个轴突连接到另一个轴突,或者将一个树突连接到另一个树突。
信号传递过程部分是电子的,部分是化学的。神经元具有电兴奋性,这是由于其膜上的电压梯度得到了维持。如果电压在短时间内发生足够大的变化,神经元就会产生一个全有或全无的电化学脉冲,称为动作电位。这个电位沿轴突迅速传播,到达突触连接时激活它们。突触信号可能是兴奋性的或抑制性的,增加或减少到达胞体的净电压。
在大多数情况下,神经元是在大脑发育和儿童时期由神经干细胞生成的。在大脑的大多数区域,神经元的生成在成年后基本停止。
神经系统
神经元是神经系统的主要组成部分,同时还有给予其结构和代谢支持的胶质细胞。神经系统由中枢神经系统和周围神经系统组成,前者包括大脑和脊髓,后者包括自主神经和躯体神经系统。在脊椎动物中,大多数神经元属于中枢神经系统,但也有一些居住在周围神经节中,许多感觉神经元位于感觉器官中,如视网膜和耳蜗。
轴突可以捆绑成束,组成周围神经系统的神经(就像电线股组成的电缆)。中枢神经系统中的轴突束被称为束 nerve tract。
解剖学和组织学
神经元对细胞信号的处理和传送是高度专业化。鉴于它们在神经系统的不同部分所执行的功能的多样性,它们的形状、大小和电化学特性也有很大差异。例如,一个神经元的胞体的直径可以从4到100微米不等。[1]
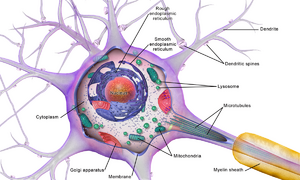
- 细胞体是神经元的主体。由于它含有细胞核,大多数蛋白质合成发生在这里。细胞核的直径可以从3到18微米不等。[2]
- 神经元的树突是有许多分支的细胞延伸。这种整体形状和结构被比喻为树突树。神经元的大部分输入是通过树突棘发生的。
- 轴突是一种较细的、像电缆一样的突起,其长度可以是胞体直径的几十倍、几百倍、甚至几万倍。轴突主要携带神经信号离开胞体,并将某些类型的信息带回胞体。许多神经元只有一个轴突,但这个轴突可能--通常也会--发生广泛的分支,从而能够与许多靶细胞进行交流。轴突从胞体中出现的部分被称为轴突丘 axon hillock。除了是一种解剖结构外,轴突丘还具有最大密度的电压依赖性钠离子通道。这使得它成为神经元最容易兴奋的部分和轴突的锋电位触发区。在电生理学方面,它具有最负的阈值电位。
- 虽然轴突和轴突丘通常会参与信息外流,但这一区域也能接受来自其他神经元的输入。
- 轴突终端 axon terminal位于轴突离胞体最远的一端,包含突触。突触结是专门的结构,神经递质化学物质在此释放,与目标神经元进行交流。除了轴突末端的突触结外,神经元还可能有沿轴突长度方向分布的 "中途结"。
公认的神经元观点将专门的功能归于其各种解剖成分;然而,树突和轴突的作用方式往往与它们所谓的主要功能相反。[3]
中枢神经系统中的轴突和树突通常只有约1微米厚,而周围神经系统中的一些轴突和树突则要厚得多。胞体的直径通常约为10-25微米,通常不比其包含的细胞核大多少。人类运动神经元最长的轴突可以超过一米长,从脊柱底部一直延伸到脚趾。
感觉神经元的轴突可以从脚趾一直延伸到脊髓的后柱,成年人的轴突长度超过1.5米。长颈鹿有几米长的单根轴突,沿其脖子的整个长度运行。人们对轴突功能的了解大多来自于对鱿鱼巨型轴突的研究,由于其相对巨大的尺寸(0.5-1毫米厚,数厘米长),这是一种理想的实验准备。
完全分化的神经元是永久性的有丝分裂后的细胞,[4]然而,存在于成人大脑中的干细胞可以在有机体的整个生命过程中再生出功能性神经元(见神经元的生成)。星形胶质细胞是星形的胶质细胞。它们已经被观察到可以凭借其类干细胞的多能性特征而变成神经元。
膜结构
像所有的动物细胞一样,每个神经元的细胞体都被一个质膜所包围,质膜是由脂质分子组成的双层膜,其中嵌入了许多类型的蛋白质结构。脂质双层是一个强大的电绝缘体,但在神经元中,嵌入膜中的许多蛋白质结构是电活性的。这些结构包括允许带电离子流过膜的离子通道和以化学方式将离子从膜的一侧输送到另一侧的离子泵。大多数离子通道只对特定类型的离子有渗透性。一些离子通道是电压门控的,这意味着它们可以通过改变膜上的电压差在开放和关闭状态之间进行切换。其他的是化学门控,意味着它们可以通过与扩散在细胞外液中的化学物质的相互作用在开放和关闭状态之间切换。离子材料包括钠、钾、氯和钙。离子通道和离子泵之间的相互作用在膜上产生一个电压差,通常在基线上小于1/10伏。这个电压有两个功能:首先,它为嵌入膜中的各种电压依赖性蛋白机械提供了动力源;其次,它为膜的不同部分之间的电信号传输提供了一个基础。
组织学和内部结构
当用嗜碱性("嗜碱")染料对神经细胞体进行染色时,可以看到许多称为尼氏体(或尼氏物质)的微观团块。这些结构由粗糙的内质网和相关的核糖体RNA组成。它们以德国精神病学家和神经病理学家弗朗茨-尼斯尔 Franz Nissl(1860-1919)的名字命名,参与蛋白质的合成,其突出性可以用神经细胞代谢非常活跃的事实来解释。嗜碱性染料如苯胺或(弱)血红蛋白[5]会突出带负电的成分,因此与核糖体RNA的磷酸盐骨架结合。
神经元的细胞体由称为神经丝的结构蛋白的复杂网状结构支撑,它与神经管(神经元微管)一起被组装成较大的神经纤维。[6] 一些神经元还含有色素颗粒,如神经黑色素(一种棕黑色的色素,是儿茶酚胺合成的副产品)和脂褐素(一种黄褐色的色素),这两种物质都会随着年龄的增长而积累。[7][8][9] 对神经元功能很重要的其他结构蛋白是肌动蛋白和微管的管蛋白。第三类β-管蛋白几乎只在神经元中发现。在神经元发育过程中,肌动蛋白主要存在于轴突和树突的顶端。在那里,肌动蛋白的动态可以通过与微管的相互作用而被调节。[10]
轴突和树突之间存在着不同的内部结构特征。典型的轴突几乎不含核糖体,除了在初始段有一些。树突含有颗粒状的内质网或核糖体,随着与细胞体距离的增加,其数量逐渐减少。
分类
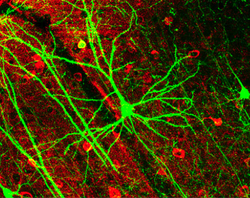
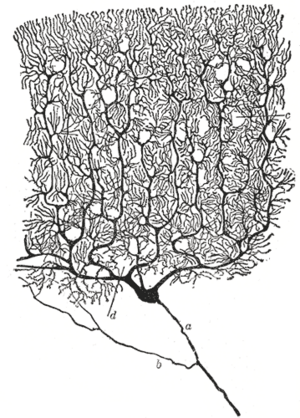
神经元的形状和大小各不相同,可按其形态和功能进行分类。[12] 解剖学家卡米洛-高尔基 Camillo Golgi将神经元分为两类:I型有长轴,用于长距离移动信号;II型有短轴,常与树突相混淆。I型细胞可按胞体的位置进一步分类。以脊髓运动神经元为代表的I型神经元的基本形态包括一个称为胞体的细胞体和一个由髓鞘覆盖的细长轴突。树突树环绕着细胞体,接收来自其他神经元的信号。轴突的末端有分支的轴突终端,将神经递质释放到终端和下一个神经元树突之间的间隙中,称为突触间隙。
结构分类
极性
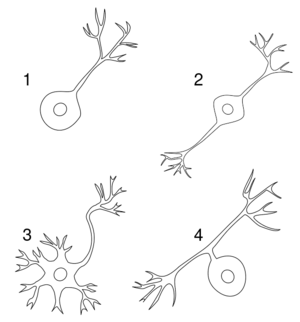
大多数神经元在解剖学上可以被描述为:
- 单极性:单一原生质过程
- 双极性:1个轴突和1个树突
- 多极性:1个轴突和2个或更多的树突
- 高尔基I型:具有长轴突的神经元;比如锥体细胞、浦肯野细胞和前角细胞。
- 高尔基II型:其轴突过程在局部投射的神经元;最好的例子是颗粒细胞
- 无轴性:轴突与树突无法区分的神经元类型。
- 假单极神经元:1个原生质过程,然后既是轴突又是树突。
其他
一些独特的神经元类型可以根据其在神经系统中的位置和独特的形状来识别。一些例子是:
- 篮状细胞 Basket cell,在目标细胞的胞体周围形成密集的终端丛,发现于大脑皮层和小脑的中间神经元。
- 贝兹细胞 Betz cell,大运动神经元
- 卢加洛细胞 Lugaro cell,小脑的中间神经元
- 中型多棘神经元 Medium spiny neuron,纹状体中的大多数神经元
- 浦肯野细胞 Purkinje cell,小脑中的巨大神经元,一种高尔基I型多极神经元
- 锥体细胞 Renshaw cell,具有三角形胞体的神经元,是高尔基I型的一种。
- 伦肖细胞 Renshaw cell,两端与α运动神经元相连的神经元
- 单极刷细胞 Unipolar brush cell,具有独特的树突末端为刷状簇的中间神经元
- 颗粒细胞 Granule cell,高尔基II型神经元的一种类型
- 前角细胞 Anterior horn,位于脊髓中的运动神经元
- 纺锤体细胞 Spindle cell,连接大脑广泛分布的中间神经元
功能分类
方向
- 传入神经元将信息从组织和器官传入中枢神经系统,也被称为感觉神经元。
- 传出神经元(运动神经元) 将信号从中枢神经系统传递给效应细胞。
- 中间神经元连接中枢神经系统特定区域内的神经元。
传入和传出也泛指分别为大脑带来信息或从大脑发出信息的神经元。
对其他神经元的影响
一个神经元通过释放一种与化学受体结合的神经递质来影响其他神经元。对突触后神经元的影响是由被激活的受体类型决定的,而不是由突触前神经元或神经递质决定的。可以认为神经递质是一把钥匙,而受体是一把锁:同一神经递质可以激活多种类型的受体。受体可大致分为兴奋性 excitatory(导致放电率增加)、抑制性 inhibitory(导致放电率下降)或调节性 modulatory(导致与放电率无直接关系的长期影响)。
大脑中最常见的两种(90%以上)神经递质,即谷氨酸和GABA,其作用基本一致。谷氨酸作用于几种类型的受体,在离子型受体上有兴奋作用,在代谢型受体上有调节作用。同样,GABA作用于几种类型的受体,但它们都有抑制作用(至少在成年动物中)。由于这种一致性,神经科学家通常把释放谷氨酸的细胞称为 "兴奋性神经元",而把释放GABA的细胞称为 "抑制性神经元"。其他一些类型的神经元也有一致的影响,例如,脊髓中释放乙酰胆碱的 "兴奋性 "运动神经元,以及释放甘氨酸的 "抑制性 "脊髓神经元。
兴奋性和抑制性神经递质之间的区别不是绝对的。相反,它取决于突触后神经元上存在的化学受体的类别。原则上,一个神经元,释放一种神经递质,可以对某些目标产生兴奋作用,对其他目标产生抑制作用,对其他目标仍有调节作用。例如,视网膜上的感光细胞在没有光的情况下不断释放神经递质谷氨酸。像大多数神经元一样,所谓的关闭双极细胞被释放的谷氨酸所激发。然而,被称为ON双极细胞的邻近目标神经元反而受到谷氨酸的抑制,因为它们缺乏典型的离子型谷氨酸受体,而是表达一类抑制性的代谢型谷氨酸受体。[13]当有光时,光感受器停止释放谷氨酸,这解除了ON双极细胞的抑制,激活了它们;这同时消除了OFF双极细胞的兴奋,使它们沉默。
根据突触前神经元表达的蛋白质,可以确定突触前神经元对突触后神经元的抑制作用的类型。表达副白蛋白的神经元通常会抑制视觉皮层中突触后神经元的输出信号,而表达躯干素的神经元通常会阻断突触后神经元的树突输入。[14]
放电模式
神经元具有内在的电反应特性,如内在的跨膜电压振荡模式。[15]因此,可以根据神经元的电生理特性对其进行分类:
- 紧张性或规律性棘波。一些神经元通常持续(紧张地)活跃,通常以恒定的频率放电。例如:神经干细胞中的中间神经元。
- 瞬变性或爆发性。爆发性放电的神经元被称为瞬变性的。
- 快闪性。一些神经元因其高放电率而引人注目,例如某些类型的皮质抑制性中间神经元、苍白球、视网膜神经节细胞。[16][17]
神经递质
神经递质是由一个神经元传递给另一个神经元或肌肉细胞或腺体细胞的化学信使。
- 胆碱能神经元--乙酰胆碱。乙酰胆碱从突触前神经元释放到突触间隙中。它是配体门控离子通道和代谢型(GPCRs:G蛋白耦联受体)毒蕈碱受体的配体。烟碱受体是由结合了尼古丁的α和β亚基组成的五聚体配体门控离子通道。配体结合后打开通道,造成Na+的流入,使其去极化,并增加突触前神经递质释放的概率。乙酰胆碱是由胆碱和乙酰辅酶A合成的。
- 肾上腺素能神经元--去甲肾上腺素。去甲肾上腺素从交感神经系统的大多数神经节后神经元释放到两组GPCRs上:α肾上腺素受体和β肾上腺素受体。去甲肾上腺素是三种常见的儿茶酚胺神经递质之一,也是周围神经系统中最普遍的一种;与其他儿茶酚胺一样,它是由酪氨酸合成的。
- GABA能神经元--γ氨基丁酸。GABA与甘氨酸一起是中枢神经系统(CNS)中的两种神经抑制剂之一。GABA具有与ACh相同的功能,对允许Cl-离子进入突触后神经元的阴离子通道进行门控。Cl-导致神经元内的超极化,随着电压变得更负,降低了动作电位放电的概率(要引发动作电位,必须达到一个正电压阈值)。GABA是由谷氨酸神经递质通过谷氨酸脱羧酶合成的。
- 谷氨酸能神经元--谷氨酸。谷氨酸与天门冬氨酸一起是两种主要的兴奋性氨基酸神经递质之一。谷氨酸受体是四类之一,其中三类是配体门控离子通道,一类是G-蛋白耦联受体(通常称为GPCR)。
- AMPA和红藻氨酸受体作为阳离子通道可渗透到Na+阳离子通道,介导快速兴奋性突触传递。
- NMDA受体是另一个对Ca2+更易渗透的阳离子通道。NMDA受体的功能取决于甘氨酸受体的结合,作为通道孔内的共轭物。如果没有这两种配体存在,NMDA受体就不能发挥作用。
- 促代谢受体,GPCRs调节突触传递和突触后兴奋性。
- 当流向大脑的血流被中断时,谷氨酸可引起兴奋性毒性,导致大脑损伤。当血流被抑制时,谷氨酸从突触前的神经元中释放出来,导致NMDA和AMPA受体的激活比压力条件以外的正常情况下更大,导致升高的Ca2+和Na+进入突触后的神经元和细胞损伤。谷氨酸是由谷氨酸合成酶从氨基酸谷氨酰胺中合成的。
- 多巴胺能神经元——多巴胺。多巴胺是一种神经递质,作用于D1型(D1和D5)Gs耦联受体,增加cAMP和PKA,以及D2型(D2、D3和D4)受体,激活Gi耦联受体,减少cAMP和PKA。多巴胺与情绪和行为有关,调节突触前和突触后的神经传递。黑质中的多巴胺神经元的丧失与帕金森病有关。多巴胺是由氨基酸酪氨酸合成的。酪氨酸被酪氨酸羟化酶催化为左旋多巴(或L-DOPA),然后左旋多巴被芳香族氨基酸脱羧酶转化为多巴胺。
- 羟色胺能神经元——羟色胺。羟色胺 5-Hydroxytryptamine(5-HT)可以起到兴奋性或抑制性作用。在其四个5-HT受体类别中,3个是GPCR,1个是配体门控的阳离子通道。羟色胺由色氨酸经色氨酸羟化酶合成,然后再经脱羧酶进一步合成。突触后神经元缺乏5-HT与抑郁症有关。阻断突触前5-羟色胺转运体的药物被用于治疗,如百忧解和左洛复。
- 嘌呤神经元——ATP。ATP是一种同时作用于配体门控离子通道(P2X受体)和GPCRs(P2Y)受体的神经递质。然而,ATP最有名的是作为一种共传导剂。这种嘌呤信号也可以由其他嘌呤介导,如腺苷,它特别作用于P2Y受体。
- 组胺能神经元——组胺。组胺是一种单胺类神经递质和神经调节剂。产生组胺的神经元存在于下丘脑的管状乳头核。[18] 组胺参与唤醒和调节睡眠/觉醒行为。
多模式分类
自2012年以来,细胞和计算神经科学界一直在推动提出一个通用的神经元分类,该分类将适用于大脑中的所有神经元以及跨物种。这是通过考虑所有神经元的三个基本属性来实现的:电生理学、形态学和细胞的个体转录组。除了具有普遍性之外,这种分类法还有一个优点,就是能够对星形胶质细胞进行分类。艾伦脑科学研究所广泛使用一种叫做Patch-Seq的方法,可以同时测量所有三种属性。[19]
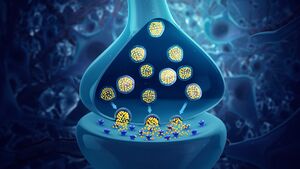
连接性
神经元通过突触相互沟通,一个细胞的轴突终端接触到另一个神经元的树突、胞体,或者更少见的轴突。像小脑中的浦肯野细胞这样的神经元可以有超过1000个树突分支,与成千上万的其他细胞建立连接; 其他的神经元,如视上核的大细胞神经元,只有一个或两个树突,每个树突接收数千个突触。
突触可以是兴奋性的或抑制性的,分别增加或减少目标神经元的活动。一些神经元还通过电突触进行交流,电突触是细胞之间直接的、导电的连接点。[20]
当动作电位到达轴突末端时,它打开电压门控的钙离子通道,允许钙离子进入末端。钙离子使充满神经递质分子的突触小泡与膜融合,将其内容释放到突触间隙中。神经递质在突触间隙中扩散,激活突触后神经元上的受体。轴突末端的高细胞钙引发线粒体钙吸收,这反过来又激活了线粒体的能量代谢,产生ATP以支持持续的神经传递。[21]
自突触是指神经元的轴突与自己的树突相连的突触。
人脑有大约8.6 x 1010(86亿)个神经元。[22]每个神经元平均有7000个与其他神经元的突触连接。据估计,一个三岁孩子的大脑大约有1015个突触(1万亿)。这个数字随着年龄的增长而下降,到成年后趋于稳定。对成年人的估计有所不同,从1014 到 5 x 1014个突触(100到500万亿)不等。[23]
非电化学信号传递
除了电和化学信号,研究表明健康人脑中的神经元还可以通过以下方式交流:
- 树突棘扩大产生的力。[24]
它们也可以被来自环境的输入和机体其他部分释放的激素所调控,[27] 这些都可以或多或少地被神经元直接影响。这也适用于神经营养素,如BDNF。肠道微生物组也与大脑有关。[28]
动作电位的传播机制
1937年,约翰-扎卡里-杨 John Zachary Young提出,乌贼巨大轴突可用于研究神经元的电特性。[29]它比人类神经元大,但与人类神经元相似,因此更容易研究。通过将电极插入乌贼巨轴突,对膜电位进行了精确测量。
轴突和胞体的细胞膜含有电压门控离子通道,使神经元能够产生和传播电信号(动作电位)。一些神经元还产生阈下膜电位振荡。这些信号是由携带电荷的离子产生和传播的,包括钠(Na+)、钾(K+)、氯(Cl−)和钙(Ca2+)。
有几种刺激可以激活神经元,导致电活动,包括压力、拉伸、化学传导物和细胞膜上的电势变化。[30]刺激导致细胞膜内特定的离子通道打开,使得离子流经细胞膜,改变膜电位。神经元必须保持界定其神经元类型的特定电特性。[31]
薄的神经元和轴突需要较少的代谢支出来产生和传导动作电位,但较粗的轴突能更快地传递冲动。为了在保持快速传导的同时尽量减少代谢支出,许多神经元的轴突周围有绝缘的髓鞘。这些髓鞘是由胶质细胞形成的:中枢神经系统的少突胶质细胞和周围神经系统的许旺细胞。髓鞘使得动作电位比相同直径的无髓轴突走得更快,同时消耗更少的能量。周围神经中的髓鞘通常沿着轴突生长,长度约为1毫米,并且点缀着无髓鞘的郎飞氏结,其中包含高密度的电压门控离子通道。多发性硬化症是一种神经系统疾病,由中枢神经系统中轴突的脱髓鞘导致。
有些神经元不产生动作电位,而是产生一个分级的电信号,反过来引起分级的神经递质释放。这样的非脉冲神经元往往是感觉神经元或中间神经元,因为它们不能长距离携带信号。
神经编码
神经编码关注的是感觉和其他信息如何在大脑中被神经元所表达。研究神经编码的主要目的是描述刺激与单个或集合神经元反应之间的关系,以及集合内神经元电活动之间的关系。[32]人们认为,神经元既可以编码数字信息,也可以编码模拟信息。[33]
全有或全无原则
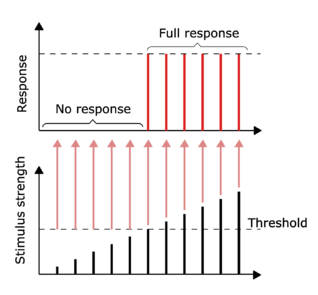
神经冲动的传导是一个全有或全无反应的例子。换句话说,如果一个神经元有任何反应,那么它必须完全响应。更大的刺激强度,如更亮的图像/更响的声音,不会产生更强的信号,但可以增加放电频率。[34]受体以不同方式回应刺激。缓慢适应的或紧张性的受体对稳定的刺激作出响应,并产生稳定的放电率。紧张性受体最常通过增加其放电频率对刺激强度的增加作出反应,通常是一个与每秒钟的脉冲相关的刺激的幂函数。这可以比喻为光的内在属性,即一个特定频率(颜色)的更大强度需要更多的光子,因为光子不能对一个特定频率变得 "更强"。
其他受体类型包括时相性或瞬变性受体,其放电随着稳定的刺激而减少或停止;比如包括皮肤,当被触摸时引起神经元放电,但如果物体保持均匀的压力,神经元就停止放电。对压力和振动有反应的皮肤和肌肉的神经元有过滤的附属结构来帮助它们发挥作用。
帕西尼氏小体就是这样一个结构。它有像洋葱一样的同心层,围绕着轴突终端形成。当施加压力使小体变形时,机械刺激被转移到轴突上,轴突就会放电。如果压力是稳定的,刺激就会结束;因此,通常这些神经元在最初的变形过程中会有短暂的去极化反应,而当压力被移除时又会有短暂的去极化反应,从而使小体再次改变形状。其他类型的适应对扩展其他一些神经元的功能很重要。[35]
词源和拼写
德国解剖学家Heinrich Wilhelm Waldeyer于1891年提出了神经元一词,其依据是古希腊语νεῦρον neuron's sinew, cord, nerve'。[36] based on the ancient Greek νεῦρον neuron 'sinew, cord, nerve'.[37]
这个词以前在法语中被采用,拼写为'neurone'。[38]这种拼法也曾被许多英语作家使用,[38]但现在在美国的用法中已经很少见,在英国的用法中也不常见。[39][37]
历史
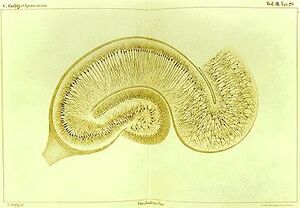
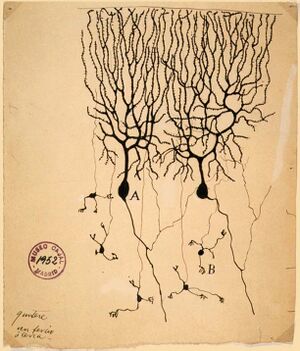
神经元作为神经系统主要功能单位的地位,在19世纪末通过西班牙解剖学家圣地亚哥-拉蒙-卡亚尔 Santiago Ramón y Cajal的作品首次得到承认。[40]
为了使单个神经元的结构清晰可见,Ramón y Cajal改进了Camillo Golgi开发的银染工艺。[40]改进后的工艺涉及一种称为 "双浸渍 "的技术,现在仍在使用。
1888年,Ramón y Cajal发表了一篇关于鸟类小脑的论文。在这篇论文中,他说他找不到轴突和树突之间结合的证据,并称每个神经元素为 "一个绝对自主的州县"[40][36],这被称为神经元学说,是现代神经科学的核心原则之一。[40]
1891年,德国解剖学家Heinrich Wilhelm Waldeyer写了一篇对神经元学说有很大影响的综述,他在其中提出了神经元这一术语来描述神经系统的解剖学和生理学单位。[41][42]
银浸渍染色法是神经解剖学研究的有效方法,因为——由于未知的原因——它只会对组织中的一小部分细胞进行染色,暴露出单个神经元的完整微观结构,而不会与其他细胞有太多的重叠。[43]
神经元学说
神经元学说是现在的一个基本观点,即神经元是神经系统的基本结构和功能单位。该理论是由圣地亚哥-拉蒙-卡亚尔在19世纪末提出的。它认为,神经元是离散的细胞(不以网状结构连接),作为新陈代谢的不同单位发挥作用。
后来的发现使这一学说得到了完善。例如,非神经元的胶质细胞在信息处理中起着至关重要的作用。[44]另外,电突触比以前认为得更常见,[45]包括神经元之间的直接胞质连接。事实上,神经元可以形成更紧密的耦合:乌贼的巨型轴突来自于多个轴突的融合。[46]
Ramón y Cajal还提出了动态极化定律,即神经元在其树突和细胞体上接收信号,并作为动作电位沿轴突向一个方向传输:离开细胞体。[47] 动态极化定律有重要的例外;树突可以作为神经元的突触输出点[48],轴突可以接受突触输入。[49]
神经元的间室模型
尽管神经元经常被描述为大脑的 "基本单位",但它们执行内部计算。神经元在树突内整合输入,这种复杂性在假定神经元是一个基本单位的模型中丢失。树突分支可以被建模为空间隔间,其活性与被动膜特性相关,但也可能因来自突触的输入的差异而有所不同。树突的间室模型对于理解那些太小而无法用电极记录的神经元的行为特别有帮助,黑腹果蝇就是这种情况。[50]
大脑中的神经元
大脑中的神经元数量因物种不同而有很大差异。[51]在人类中,大脑皮层中估计有100-200亿个神经元,小脑中有550-700亿个神经元。[52]相比之下,秀丽隐杆线虫只有302个神经元,使其成为理想的模型生物,因为科学家已经能够绘制其所有的神经元。黑腹果蝇是生物实验中常见的对象,它有大约10万个神经元,表现出许多复杂的行为。神经元的许多特性,从使用的神经递质类型到离子通道组成,在不同的物种中都保持不变,使科学家能够在更简单的实验系统中研究发生在更复杂生物体中的过程。
神经系统疾病
腓骨肌萎缩症 Charcot–Marie–Tooth disease(CMT)是一种异质性的遗传性神经疾病(神经病变),其特点是肌肉组织和触觉的丧失,主要是在脚和腿上,在晚期会延伸到手和胳膊。该病目前无法治愈,是最常见的遗传性神经系统疾病之一,每10万人中会有36人罹患此病。[53]
阿尔茨海默病 Alzheimer's disease(AD),是一种神经退行性疾病,其特点是认知能力逐渐退化,伴随着日常生活活动能力下降和神经精神症状或行为变化。[54]最突出的早期症状是短期记忆的丧失(失忆),通常表现为轻微的遗忘,随着病情的发展,遗忘的程度会逐渐加重,但老的记忆却记忆得相对清楚。随着病情的发展,认知(智力)损害扩展到语言(失语)、熟练动作(失用)和识别(失认)等领域,决策和计划等功能也会受到损害。[55][56]
帕金森病 Parkinson's disease(PD),是一种中枢神经系统的退行性疾病,通常会损害运动技能和语言能力。[57] 帕金森病属于一组被称为运动障碍的疾病。[58]它的特点是肌肉僵硬、震颤、身体运动变慢(运动迟缓),在极端情况下,身体运动丧失(运动不能)。主要症状是基底神经节对运动皮层刺激减少的结果,通常是由于大脑多巴胺能神经元中产生的多巴胺形成和作用不足造成的。次要症状可能包括高水平的认知功能障碍和微妙的语言问题。帕金森病既是慢性的,也是渐进的。
重症肌无力 Myasthenia gravis是一种神经肌肉疾病,导致简单活动时出现波动性的肌肉无力和疲劳。肌无力通常是由阻断突触后神经肌肉接头处的乙酰胆碱受体的循环抗体引起的,它抑制了神经递质乙酰胆碱的刺激作用。肌无力症用免疫抑制剂、胆碱酯酶抑制剂来治疗,在某些情况下还可以进行胸腺切除术。
脱髓鞘症
脱髓鞘 Demyelination是指脱髓鞘的行为,或绝缘于神经的髓鞘的丧失。当髓鞘退化时,信号沿神经的传导会受到影响或丧失,神经最终会萎缩。这导致了某些神经退行性疾病,如多发性硬化症和慢性炎症性脱髓鞘多发性神经病。
轴突变性
尽管大多数损伤反应包括钙离子流入信号,以促进断裂部分的重新愈合,但轴突损伤最初会导致急性轴突变性,即在损伤后30分钟内近端和远端迅速分离。退化后,轴突肿胀,最终形成串珠状肿胀。轴索细胞骨架和内部细胞器的颗粒状解体发生在轴索退化之后。早期的变化包括线粒体在损伤部位的结旁区堆积。内质网降解、线粒体膨胀并最终解体。解体依赖于泛素和钙蛋白酶(由钙离子的涌入引起),表明轴突变性是一个完全破碎的活跃过程。这一过程在PNS(周围神经系统)中大约需要24小时,在CNS(中枢神经系统)中则需要更长时间。导致轴突变性的信号传导途径尚不清楚。
神经发生
神经元是通过神经发生的过程诞生的,其中神经干细胞分裂产生分化的神经元。一旦完全分化的神经元形成,它们就不再能够进行有丝分裂。神经发生主要发生在大多数生物体的胚胎中。
成年神经 Adult neurogenesis发生能够发生,对人类神经元年龄的研究表明,这一过程只发生在少数细胞中,新皮层中的绝大多数神经元在出生前就已形成,并持续存在而不被替换。人类中成年神经发生存在的程度,以及它对认知的贡献是有争议的,2018年发表的报告相互矛盾。[59]
人体含有各种干细胞类型,它们有能力分化为神经元。研究人员发现了一种利用横向分化将人类皮肤细胞转化为神经细胞的方法,其中 "细胞被迫采用新的身份"。[60]
在哺乳动物大脑的神经发生过程中,祖细胞和干细胞从增殖性分裂发展到分化性分裂。这一进展导致了皮层中的神经元和胶质细胞的出现。表观遗传学修饰在调节分化中的神经干细胞的基因表达方面起着关键作用,对发育中和成年哺乳动物大脑中的细胞命运决定至关重要。表观遗传修饰包括DNA胞嘧啶甲基化形成5-甲基胞嘧啶和5-甲基胞嘧啶去甲基化。[61]这些修饰对于发育中和成年哺乳动物大脑的细胞命运决定至关重要。DNA胞嘧啶甲基化是由DNA甲基转移酶(DNMTs)催化的。甲基胞嘧啶去甲基化是由进行氧化反应(如5-甲基胞嘧啶到5-羟甲基胞嘧啶)的TET酶和DNA碱基切除修复(BER)途径的酶分几个阶段催化的。[61]
在哺乳动物神经系统发育的不同阶段,有两种DNA修复过程被用于修复DNA双链断裂。这些途径是用于增殖期神经前体细胞的同源重组修复,以及主要用于后期发育阶段的非同源末端连接。[62]
神经再生
外围轴突如果被切断,可以重新生长,[63]但一个神经元在功能上不能被另一种类型的神经元取代(Llinás法则)。[15]
另见
参考文献
- ↑ Davies, Melissa (2002-04-09). "The Neuron: size comparison". Neuroscience: A journey through the brain. Retrieved 2009-06-20.
- ↑ Chudler, Eric H. "Brain Facts and Figures". Neuroscience for Kids. Retrieved 2009-06-20.
- ↑ "16.7: Nervous System". Biology LibreTexts (in English). 2021-01-14. Retrieved 2022-02-28.
- ↑ Herrup K, Yang Y (May 2007). "Cell cycle regulation in the postmitotic neuron: oxymoron or new biology?". Nature Reviews. Neuroscience. 8 (5): 368–78. doi:10.1038/nrn2124. PMID 17453017.
- ↑ [[[:模板:Google books]] State Hospitals Bulletin]. State Commission in Lunacy.. 1897. p. 378. 模板:Google books.
- ↑ "Medical Definition of Neurotubules". www.merriam-webster.com.
- ↑ Zecca L, Gallorini M, Schünemann V, Trautwein AX, Gerlach M, Riederer P, Vezzoni P, Tampellini D (March 2001). "Iron, neuromelanin and ferritin content in the substantia nigra of normal subjects at different ages: consequences for iron storage and neurodegenerative processes". Journal of Neurochemistry. 76 (6): 1766–73. doi:10.1046/j.1471-4159.2001.00186.x. PMID 11259494.
- ↑ Herrero MT, Hirsch EC, Kastner A, Luquin MR, Javoy-Agid F, Gonzalo LM, Obeso JA, Agid Y (1993). "Neuromelanin accumulation with age in catecholaminergic neurons from Macaca fascicularis brainstem". Developmental Neuroscience. 15 (1): 37–48. doi:10.1159/000111315. PMID 7505739.
- ↑ Brunk UT, Terman A (September 2002). "Lipofuscin: mechanisms of age-related accumulation and influence on cell function". Free Radical Biology & Medicine. 33 (5): 611–9. doi:10.1016/s0891-5849(02)00959-0. PMID 12208347.
- ↑ Zhao B, Meka DP, Scharrenberg R, König T, Schwanke B, Kobler O, Windhorst S, Kreutz MR, Mikhaylova M, Calderon de Anda F (August 2017). "Microtubules Modulate F-actin Dynamics during Neuronal Polarization". Scientific Reports. 7 (1): 9583. Bibcode:2017NatSR...7.9583Z. doi:10.1038/s41598-017-09832-8. PMC 5575062. PMID 28851982.
- ↑ Lee WC, Huang H, Feng G, Sanes JR, Brown EN, So PT, Nedivi E (February 2006). "Dynamic remodeling of dendritic arbors in GABAergic interneurons of adult visual cortex". PLOS Biology. 4 (2): e29. doi:10.1371/journal.pbio.0040029. PMC 1318477. PMID 16366735.
- ↑ Al, Martini, Frederic Et. [[[:模板:Google books]] Anatomy and Physiology' 2007 Ed.2007 Edition]. Rex Bookstore, Inc.. pp. 288. ISBN 978-971-23-4807-5. 模板:Google books.
- ↑ Gerber U (January 2003). "Metabotropic glutamate receptors in vertebrate retina". Documenta Ophthalmologica. Advances in Ophthalmology. 106 (1): 83–7. doi:10.1023/A:1022477203420. PMID 12675489.
- ↑ Wilson NR, Runyan CA, Wang FL, Sur M (August 2012). "Division and subtraction by distinct cortical inhibitory networks in vivo". Nature. 488 (7411): 343–8. Bibcode:2012Natur.488..343W. doi:10.1038/nature11347. hdl:1721.1/92709. PMC 3653570. PMID 22878717.
- ↑ 15.0 15.1 Llinás RR (2014-01-01). "Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective". Frontiers in Cellular Neuroscience. 8: 320. doi:10.3389/fncel.2014.00320. PMC 4219458. PMID 25408634.
- ↑ Kolodin YO, Veselovskaia NN, Veselovsky NS, Fedulova SA. Ion conductances related to shaping the repetitive firing in rat retinal ganglion cells. Acta Physiologica Congress. Archived from the original on 2012-10-07. Retrieved 2009-06-20.
- ↑ "Ionic conductances underlying excitability in tonically firing retinal ganglion cells of adult rat". Ykolodin.50webs.com. 2008-04-27. Retrieved 2013-02-16.
- ↑ Scammell TE, Jackson AC, Franks NP, Wisden W, Dauvilliers Y (January 2019). "Histamine: neural circuits and new medications". Sleep. 42 (1). doi:10.1093/sleep/zsy183. PMC 6335869. PMID 30239935.
- ↑ "Patch-seq technique helps depict the variation of neural cells in the brain". News-medical.net. 3 December 2020. Retrieved 26 August 2021.
{{cite web}}: CS1 maint: url-status (link) - ↑ Macpherson, Gordon (2002). Black's Medical Dictionary (40 ed.). Lanham, MD: Scarecrow Press. pp. 431–434. ISBN 0810849844.
- ↑ Ivannikov MV, Macleod GT (June 2013). "Mitochondrial free Ca²⁺ levels and their effects on energy metabolism in Drosophila motor nerve terminals". Biophysical Journal. 104 (11): 2353–61. Bibcode:2013BpJ...104.2353I. doi:10.1016/j.bpj.2013.03.064. PMC 3672877. PMID 23746507.
- ↑ Herculano-Houzel S (November 2009). "The human brain in numbers: a linearly scaled-up primate brain". Frontiers in Human Neuroscience. 3: 31. doi:10.3389/neuro.09.031.2009. PMC 2776484. PMID 19915731.
- ↑ Drachman DA (June 2005). "Do we have brain to spare?". Neurology. 64 (12): 2004–5. doi:10.1212/01.WNL.0000166914.38327.BB. PMID 15985565.
- ↑ Ucar, Hasan; Watanabe, Satoshi; Noguchi, Jun; Morimoto, Yuichi; Iino, Yusuke; Yagishita, Sho; Takahashi, Noriko; Kasai, Haruo (December 2021). "Mechanical actions of dendritic-spine enlargement on presynaptic exocytosis". Nature (in English). 600 (7890): 686–689. doi:10.1038/s41586-021-04125-7. ISSN 1476-4687.
Lay summary:
"Forceful synapses reveal mechanical interactions in the brain". Nature (in English). 24 November 2021. doi:10.1038/d41586-021-03516-0. Retrieved 21 February 2022. - ↑ "Researchers discover new type of cellular communication in the brain". The Scripps Research Institute (in English). Retrieved 12 February 2022.
- ↑ Schiapparelli, Lucio M.; Sharma, Pranav; He, Hai-Yan; Li, Jianli; Shah, Sahil H.; McClatchy, Daniel B.; Ma, Yuanhui; Liu, Han-Hsuan; Goldberg, Jeffrey L.; Yates, John R.; Cline, Hollis T. (25 January 2022). "Proteomic screen reveals diverse protein transport between connected neurons in the visual system". Cell Reports (in English). 38 (4). doi:10.1016/j.celrep.2021.110287. ISSN 2211-1247.
- ↑ Levitan, Irwin B.; Kaczmarek, Leonard K. "Electrical Signaling in Neurons". Oxford University Press. doi:10.1093/med/9780199773893.001.0001/med-9780199773893-chapter-3.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ O’Leary, Olivia F.; Ogbonnaya, Ebere S.; Felice, Daniela; Levone, Brunno R.; C. Conroy, Lorraine; Fitzgerald, Patrick; Bravo, Javier A.; Forsythe, Paul; Bienenstock, John; Dinan, Timothy G.; Cryan, John F. (1 February 2018). "The vagus nerve modulates BDNF expression and neurogenesis in the hippocampus". European Neuropsychopharmacology (in English). 28 (2): 307–316. doi:10.1016/j.euroneuro.2017.12.004. ISSN 0924-977X.
- ↑ Chudler, Eric H. "Milestones in Neuroscience Research". Neuroscience for Kids. Retrieved 2009-06-20.
- ↑ Patlak, Joe; Gibbons, Ray (2000-11-01). "Electrical Activity of Nerves". Action Potentials in Nerve Cells. Archived from the original on August 27, 2009. Retrieved 2009-06-20.
- ↑ Harris-Warrick, RM (October 2011). "Neuromodulation and flexibility in Central Pattern Generator networks". Current Opinion in Neurobiology. 21 (5): 685–92. doi:10.1016/j.conb.2011.05.011. PMC 3171584. PMID 21646013.
- ↑ Brown EN, Kass RE, Mitra PP (May 2004). "Multiple neural spike train data analysis: state-of-the-art and future challenges". Nature Neuroscience. 7 (5): 456–61. doi:10.1038/nn1228. PMID 15114358.
- ↑ "Spike arrival times: A highly efficient coding scheme for neural networks" (in en). [[[:模板:Google books]] Parallel processing in neural systems and computers]. North-Holland. 1990. pp. 91–94. ISBN 9780444883902. http://pop.cerco.ups-tlse.fr/fr_vers/documents/thorpe_sj_90_91.pdf.
- ↑ 34.0 34.1 Kalat, James W (2016). Biological psychology (12 ed.). Australia. ISBN 9781305105409. OCLC 898154491.
- ↑ Eckert, Roger; Randall, David (1983). Animal physiology: mechanisms and adaptations. San Francisco: W.H. Freeman. p. 239. ISBN 978-0-7167-1423-1. https://archive.org/details/animalphysiology0000ecke/page/239.
- ↑ 36.0 36.1 Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391. https://www.google.com/books/edition/_/BdRqAAAAMAAJ?hl=en&gbpv=1&pg=PA47. "Ramon y Cajal's first paper on the Golgi stain was on the bird cerebellum, and it appeared in the Revista in 1888. He acknowledged that he found the nerve fibers to be very intricate, but stated that he could find no evidence for either axons or dendrites undergoing anastomosis and forming nets. He called each nervous element 'an absolutely autonomous canton.'"
- ↑ 37.0 37.1 Oxford English Dictionary, 3rd edition, 2003, s.v.
- ↑ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (January 2020). "Grey Matter Etymology and the neuron(e)". Brain. 143 (1): 374–379. doi:10.1093/brain/awz367. PMC 6935745. PMID 31844876.
- ↑ "Google Books Ngram Viewer". books.google.com (in English). Retrieved 19 December 2020.
- ↑ 40.0 40.1 40.2 40.3 López-Muñoz F, Boya J, Alamo C (October 2006). "Neuron theory, the cornerstone of neuroscience, on the centenary of the Nobel Prize award to Santiago Ramón y Cajal". Brain Research Bulletin. 70 (4–6): 391–405. doi:10.1016/j.brainresbull.2006.07.010. PMID 17027775.
{{cite journal}}: Cite has empty unknown parameter:|1=(help) - ↑ Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391. https://www.google.com/books/edition/_/BdRqAAAAMAAJ?hl=en&gbpv=1&pg=PA47. "... a man who would write a highly influential review of the evidence in favor of the neuron doctrine two years later. In his paper, Waldeyer (1891), ... , wrote that nerve cells terminate freely with end arborizations and that the 'neuron' is the anatomical and physiological unit of the nervous system. The word 'neuron' was born this way."
- ↑ "Whonamedit - dictionary of medical eponyms". www.whonamedit.com.
Today, Wilhelm von Waldeyer-Hartz is remembered as the founder of the neurone theory, coining the term "neurone" to describe the cellular function unit of the nervous system and enunciating and clarifying that concept in 1891.
- ↑ Grant G (October 2007). "How the 1906 Nobel Prize in Physiology or Medicine was shared between Golgi and Cajal". Brain Research Reviews. 55 (2): 490–8. doi:10.1016/j.brainresrev.2006.11.004. PMID 17306375.
- ↑ Witcher MR, Kirov SA, Harris KM (January 2007). "Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus". Glia. 55 (1): 13–23. CiteSeerX 10.1.1.598.7002. doi:10.1002/glia.20415. PMID 17001633.
- ↑ Connors BW, Long MA (2004). "Electrical synapses in the mammalian brain". Annual Review of Neuroscience. 27 (1): 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ↑ Guillery RW (June 2005). "Observations of synaptic structures: origins of the neuron doctrine and its current status". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 360 (1458): 1281–307. doi:10.1098/rstb.2003.1459. PMC 1569502. PMID 16147523.
- ↑ Sabbatini RM (April–July 2003). "Neurons and Synapses: The History of Its Discovery". Brain & Mind Magazine: 17.
- ↑ Djurisic M, Antic S, Chen WR, Zecevic D (July 2004). "Voltage imaging from dendrites of mitral cells: EPSP attenuation and spike trigger zones". The Journal of Neuroscience. 24 (30): 6703–14. doi:10.1523/JNEUROSCI.0307-04.2004. hdl:1912/2958. PMC 6729725. PMID 15282273.
- ↑ Cochilla AJ, Alford S (March 1997). "Glutamate receptor-mediated synaptic excitation in axons of the lamprey". The Journal of Physiology. 499 (Pt 2): 443–57. doi:10.1113/jphysiol.1997.sp021940. PMC 1159318. PMID 9080373.
- ↑ Gouwens NW, Wilson RI (2009). "Signal propagation in Drosophila central neurons". Journal of Neuroscience. 29 (19): 6239–6249. doi:10.1523/jneurosci.0764-09.2009. PMC 2709801. PMID 19439602.
- ↑ Williams RW, Herrup K (1988). "The control of neuron number". Annual Review of Neuroscience. 11 (1): 423–53. doi:10.1146/annurev.ne.11.030188.002231. PMID 3284447.
- ↑ von Bartheld CS, Bahney J, Herculano-Houzel S (December 2016). "The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting". The Journal of Comparative Neurology. 524 (18): 3865–3895. doi:10.1002/cne.24040. PMC 5063692. PMID 27187682.
- ↑ Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, Kamholz J, Shy ME (July 2000). "Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A". Brain. 123 (7): 1516–27. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ↑ "About Alzheimer's Disease: Symptoms". National Institute on Aging. Archived from the original on 15 January 2012. Retrieved 28 December 2011.
- ↑ Burns A, Iliffe S (February 2009). "Alzheimer's disease". BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745.
- ↑ Querfurth HW, LaFerla FM (January 2010). "Alzheimer's disease". The New England Journal of Medicine. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219.
- ↑ "Parkinson's Disease Information Page". NINDS. 30 June 2016. Archived from the original on 4 January 2017. Retrieved 18 July 2016.
- ↑ "Movement Disorders". The International Neuromodulation Society.
- ↑ Kempermann G, Gage FH, Aigner L, Song H, Curtis MA, Thuret S, Kuhn HG, Jessberger S, Frankland PW, Cameron HA, Gould E, Hen R, Abrous DN, Toni N, Schinder AF, Zhao X, Lucassen PJ, Frisén J (July 2018). "Human Adult Neurogenesis: Evidence and Remaining Questions". Cell Stem Cell. 23 (1): 25–30. doi:10.1016/j.stem.2018.04.004. PMC 6035081. PMID 29681514.
- ↑ Callaway, Ewen (26 May 2011). "How to make a human neuron". Nature. doi:10.1038/news.2011.328.
By transforming cells from human skin into working nerve cells, researchers may have come up with a model for nervous-system diseases and perhaps even regenerative therapies based on cell transplants. The achievement, reported online today in Nature, is the latest in a fast-moving field called transdifferentiation, in which cells are forced to adopt new identities. In the past year, researchers have converted connective tissue cells found in skin into heart cells, blood cells, and liver cells.
- ↑ 61.0 61.1 Wang Z, Tang B, He Y, Jin P (March 2016). "DNA methylation dynamics in neurogenesis". Epigenomics. 8 (3): 401–14. doi:10.2217/epi.15.119. PMC 4864063. PMID 26950681.
- ↑ Orii KE, Lee Y, Kondo N, McKinnon PJ (June 2006). "Selective utilization of nonhomologous end-joining and homologous recombination DNA repair pathways during nervous system development". Proceedings of the National Academy of Sciences of the United States of America. 103 (26): 10017–22. Bibcode:2006PNAS..10310017O. doi:10.1073/pnas.0602436103. PMC 1502498. PMID 16777961.
- ↑ Yiu G, He Z (August 2006). "Glial inhibition of CNS axon regeneration". Nature Reviews. Neuroscience. 7 (8): 617–27. doi:10.1038/nrn1956. PMC 2693386. PMID 16858390.
进一步阅读
- Bullock TH, Bennett MV, Johnston D, Josephson R, Marder E, Fields RD (November 2005). "Neuroscience. The neuron doctrine, redux". Science. 310 (5749): 791–3. doi:10.1126/science.1114394. PMID 16272104.
- Principles of Neural Science (4th ed.). New York: McGraw-Hill. 2000. ISBN 0-8385-7701-6.
- The Fine Structure of the Nervous System (3rd ed.). New York: Oxford University Press. 1991. ISBN 0-19-506571-9.
- Histology (10th ed.). Baltimore: Wood. 1933.
- Neurones without Impulses. Cambridge: Cambridge University Press. 1981. ISBN 0-521-29935-7.
- (in en) Clinical Neuroanatomy. Lippincott Williams & Wilkins. 2010. ISBN 978-0-7817-9427-5. https://www.google.com/books/edition/_/ABPmvroyrD0C.
外部链接
- 模板:Curlie
- IBRO (国际大脑研究组织). 促进神经科学研究,尤其是在资金不足的国家。
- NeuronBank 是一个在线神经病学工具,用于编目神经元类型和突触连接。
- 灵长类动物和非灵长类动物大脑的高分辨率神经解剖图像。.
- NIF 搜索-神经元通过神经科学信息框架
- 细胞中心数据库-神经元
- [1] 根据 Petilla 公约,在 NeuroLex。
- NeuroMorpho.Org 一个神经形态学数字重建的在线数据库
- 免疫组织化学图像库:神经元
- Khan学院:神经元的解剖
- 神经元图像
本中文词条由Autumnwolfberry翻译,薄荷编辑,如有问题,欢迎在讨论页面留言。
本词条内容源自wikipedia及公开资料,遵守 CC3.0协议。