“突触”的版本间的差异
(→突触前调制) |
|||
| 第26行: | 第26行: | ||
[[文件:Blausen 0843 SynapseTypes.png|链接=link=Special:FilePath/Blausen_0843_SynapseTypes.png|替代=|居中|缩略图|Different types of synapses]] | [[文件:Blausen 0843 SynapseTypes.png|链接=link=Special:FilePath/Blausen_0843_SynapseTypes.png|替代=|居中|缩略图|Different types of synapses]] | ||
==记忆中的作用== | ==记忆中的作用== | ||
| − | + | 突触在记忆形成中的重要作用已获广泛的认可。当神经递质跨突触间隙后激活受体时,突触前后的两个神经元如果是同时发生活跃时,两者之间的连接就会加强,这是受体信号通路机制产生的结果。两个神经通路之间的连接强度可以存储信息,从而产生了记忆。这种突触强化的过程被称为长时程增强<ref>{{cite journal |last=Lynch |first=M. A. |date=January 1, 2004 |title=Long-Term Potentiation and Memory |journal=[[Physiological Reviews]] |volume=84 |issue=1 |pages=87–136 |pmid=14715912 |doi=10.1152/physrev.00014.2003 |url=https://zenodo.org/record/896261 }}</ref>。 | |
突触的可塑性可以通过改变神经递质释放,从而在突触前细胞中进行控制;也可以通过改变细胞膜上受体的数量和功能,在突触后细胞进行调节。突触后信号的改变,多与突触后细胞钙内流引起的 N-甲基-D-天冬氨酸受体(NMDAR)依赖的长时程增强(long-term potentiation, LTP)和长时程抑制([[long-term depression|long-term depression,]] LTD)有关。LTP 和 LTD 是研究最多的兴奋性突触可塑性形式<ref name=":11">{{cite journal |last1=Krugers |first1=Harm J. |last2=Zhou |first2=Ming |last3=Joëls |first3= Marian |last4=Kindt |first4=Merel |date=October 11, 2011 |title=Regulation of Excitatory Synapses and Fearful Memories by Stress Hormones |journal=Frontiers in Behavioral Neuroscience |volume=5 |pages=62 |location=Switzerland |publisher=[[Frontiers (publisher)|Frontiers Media SA]] |doi=10.3389/fnbeh.2011.00062 |pmc=3190121 |pmid=22013419|doi-access=free }}</ref>。 | 突触的可塑性可以通过改变神经递质释放,从而在突触前细胞中进行控制;也可以通过改变细胞膜上受体的数量和功能,在突触后细胞进行调节。突触后信号的改变,多与突触后细胞钙内流引起的 N-甲基-D-天冬氨酸受体(NMDAR)依赖的长时程增强(long-term potentiation, LTP)和长时程抑制([[long-term depression|long-term depression,]] LTD)有关。LTP 和 LTD 是研究最多的兴奋性突触可塑性形式<ref name=":11">{{cite journal |last1=Krugers |first1=Harm J. |last2=Zhou |first2=Ming |last3=Joëls |first3= Marian |last4=Kindt |first4=Merel |date=October 11, 2011 |title=Regulation of Excitatory Synapses and Fearful Memories by Stress Hormones |journal=Frontiers in Behavioral Neuroscience |volume=5 |pages=62 |location=Switzerland |publisher=[[Frontiers (publisher)|Frontiers Media SA]] |doi=10.3389/fnbeh.2011.00062 |pmc=3190121 |pmid=22013419|doi-access=free }}</ref>。 | ||
| 第46行: | 第46行: | ||
通过 G 蛋白偶联受体(GPCR)对神经递质释放进行调节是突触传递的主要突触前机制。GPCR 位于突触前末端,激活 GPCRs 可以降低神经递质释放的概率。这种突触前抑制涉及 Gi/o 型的 G 蛋白的激活,介导不同的抑制机制,包括抑制电压门控钙离子通道、激活钾离子通道,或直接抑制囊泡融合过程。一个例子是内源性大麻素,其在突触后神经元合成和释放,通过逆向信号通路(突触后神经元合成与释放的分子反向作用到突触前末梢),作用于突触前膜的同源受体,比如 CB1 受体,引起短期(STD)或长期的突触抑制(LTD),导致短期或长期神经递质释放减少<ref name=":15">{{Citation|last=Lovinger|first=David M.|chapter=Presynaptic Modulation by Endocannabinoids|date=2008|pages=435–477|editor-last=Südhof|editor-first=Thomas C.|series=Handbook of Experimental Pharmacology|publisher=Springer Berlin Heidelberg|language=en|doi=10.1007/978-3-540-74805-2_14|pmid=18064422|isbn=9783540748052|editor2-last=Starke|editor2-first=Klaus|title=Pharmacology of Neurotransmitter Release|volume=184|issue=184}}</ref>。 | 通过 G 蛋白偶联受体(GPCR)对神经递质释放进行调节是突触传递的主要突触前机制。GPCR 位于突触前末端,激活 GPCRs 可以降低神经递质释放的概率。这种突触前抑制涉及 Gi/o 型的 G 蛋白的激活,介导不同的抑制机制,包括抑制电压门控钙离子通道、激活钾离子通道,或直接抑制囊泡融合过程。一个例子是内源性大麻素,其在突触后神经元合成和释放,通过逆向信号通路(突触后神经元合成与释放的分子反向作用到突触前末梢),作用于突触前膜的同源受体,比如 CB1 受体,引起短期(STD)或长期的突触抑制(LTD),导致短期或长期神经递质释放减少<ref name=":15">{{Citation|last=Lovinger|first=David M.|chapter=Presynaptic Modulation by Endocannabinoids|date=2008|pages=435–477|editor-last=Südhof|editor-first=Thomas C.|series=Handbook of Experimental Pharmacology|publisher=Springer Berlin Heidelberg|language=en|doi=10.1007/978-3-540-74805-2_14|pmid=18064422|isbn=9783540748052|editor2-last=Starke|editor2-first=Klaus|title=Pharmacology of Neurotransmitter Release|volume=184|issue=184}}</ref>。 | ||
| − | + | ==References == | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | ==References== | ||
{{Reflist|30em}} | {{Reflist|30em}} | ||
2022年5月16日 (一) 14:45的版本
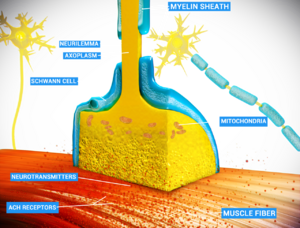
在神经系统中,神经元(即神经细胞)通过称为突触[1] 的结构,将电信号或化学信号传递给其他神经元或效应靶细胞。
突触对于神经冲动在神经元之间传递是至关重要的。神经元是特化的向靶细胞传递信号的细胞,突触正是它们传递信号的手段。在突触处,传递信号的神经元(突触前神经元)与目标细胞(突触后细胞)的质膜紧密相对。突触前和突触后位点都包含大量的分子结构阵列,这些分子结构连接两个膜并执行信号传导过程[2] 。在许多突触中,突触前部分位于轴突,突触后部分位于树突或胞体上。星形胶质细胞也与突触神经元交换信息,对突触活动做出反应,从而调节神经传导。突触前和突触后神经元的突触粘附分子(SAMs)部分重叠而粘附在一起,将突触(至少化学突触)稳定在其位置;SAMs 也可能有助于突触的产生与功能[3]。
一些作者将突触的概念进行了扩展,以包括从神经元到任何其他细胞类型,比如到运动细胞(尽管这种非神经元的接触可能被称为接头,一个有些历史的术语)的通讯[4] 。Sanford Palay 的一项具有里程碑意义的研究证明了突触的存在[5]。
概念的历史
Santiago Ramón y Cajal 提出身体内的神经元之间并不是连续的,但仍然相互交流,即所谓的神经元学说[6] 。突触的英文单词(synapse)是由英国神经生理学家 Charles Sherrington 于1897年在迈克尔 · 福斯特的《生理学教科书》中引入的 [1] 。Sherrington 想找个好用的名词,以突出两个独立单元之间的结合,而实际上“synapse”一词是由福斯特的朋友、英国古典学者 Arthur Woollgar Verrall 提议的 [7][8] 。这个词来源于希腊语 synapsis,意指“连接”,它又来源于“together”和“ to fasten”。
突触间隙当时作为理论上的构造,有被表述为轴突末端与树突或胞体之间的不连续性。但这种突触前后膜的分离,现在我们知道约有 20 纳米,用当时最好的光学显微镜进行组织学观察是无法分辨的。直到 20 世纪 50 年代,用电子显微镜才显示了突触的精细结构,突触前和突触后分离的、平行的细胞膜与突起,以及两者之间的间隙[9][10]。
化学突触和电突触
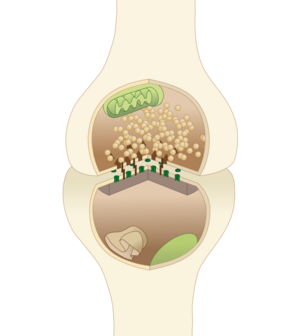
存在两种完全不同类型的突触:
- 在化学突触,突触前神经元的电活动(通过激活电压门控钙通道)被转化为称为神经递质的化学物质的释放。神经递质可与位于突触后膜上的受体结合,从而引起电反应,或通过第二信使通路激发或抑制突触后神经元。化学突触可以根据所释放的神经递质进行分类: 谷氨酸能(通常是兴奋性的)、GABA能(通常是抑制性的)、胆碱能(比如,脊椎动物神经肌肉接头)和肾上腺素能(释放去甲肾上腺素)。由于受体信号转导的复杂性,化学突触可以对突触后细胞产生复杂的效应。
- 电突触,突触前、后的细胞膜通过特殊的称为缝隙连接的通道连接。这些通道允许电流通过,使得突触前细胞的电压变化能引起突触后细胞的电位变化。电突触的主要优点是细胞间的信号传递是极快的[11]。
不同于突触通信,假突触耦合允许神经元之间通过间接的电场进行通信。
自突触是一类化学突触或电突触,神经元的轴突会与自身的树突形成突触。
接合类型
突触可以按构成突触前和突触后的神经元部位进行分类。哺乳动物神经系统中的绝大多数突触是经典的轴树突触(轴突到树突的突触) ,然而存在其它的排列方式,包括但不限于轴轴突触、树树突触、轴分泌突触、体树突触、树体突触和体体突触。
轴突跨突触释放神经递质于树突、胞体、其他轴突或轴突末梢,也可以进入血流或扩散到邻近的神经组织。
记忆中的作用
突触在记忆形成中的重要作用已获广泛的认可。当神经递质跨突触间隙后激活受体时,突触前后的两个神经元如果是同时发生活跃时,两者之间的连接就会加强,这是受体信号通路机制产生的结果。两个神经通路之间的连接强度可以存储信息,从而产生了记忆。这种突触强化的过程被称为长时程增强[12]。
突触的可塑性可以通过改变神经递质释放,从而在突触前细胞中进行控制;也可以通过改变细胞膜上受体的数量和功能,在突触后细胞进行调节。突触后信号的改变,多与突触后细胞钙内流引起的 N-甲基-D-天冬氨酸受体(NMDAR)依赖的长时程增强(long-term potentiation, LTP)和长时程抑制(long-term depression, LTD)有关。LTP 和 LTD 是研究最多的兴奋性突触可塑性形式[13]。
研究模型
因技术原因,历史上对突触结构和功能的研究都是在较大的突触模型上进行的,例如:
- 乌贼的巨突触
- 神经肌肉接头,在脊椎动物是胆碱能,昆虫中是谷氨酸能
- 鸡的睫状神经节的睫状体萼[14]
- 视网膜的带突触,
- 海马的 Schaffer 侧枝突触
突触极性
神经元的功能依赖于细胞极性。神经细胞独特的结构使得动作电位可以单向传递(从树突到细胞体再到轴突) ,这些信号可以被突触后神经元接收和传递,或者被效应细胞接收。长期以来,神经细胞一直被用作细胞极性的模型,尤其用来研究突触分子极性定位的机制。受肌醇单磷酸酶(IMPase) 调节的 PIP2 信号通路在突触极性中起着重要作用。
磷脂酰肌醇(PIP、PIP2 和 PIP3)已被证明是影响神经元极性的分子[15] 。在秀丽线虫中鉴定的基因 ttx-7,编码 IMPase——一种使磷酸肌醇脱磷酸化产生肌醇的酶。ttx-7 基因突变的线虫表现出行为和蛋白定位缺陷,而这些缺陷是通过表达 IMPase 而恢复。这些可以得出,IMPase 对突触组成蛋白的正确定位是必要的[16][17] 。Egl-8 基因编码磷脂酶 Cβ(PLCβ)的同源基因。当 ttx-7 突变体也发生 egl-8 基因突变时,由 ttx-7 基因突变导致的的缺陷表型可以很大程度被逆转。这些结果表明,PIP2 信号通路建立了神经元中突触组成蛋白的极性定位.[16]。
突触前调制
通过 G 蛋白偶联受体(GPCR)对神经递质释放进行调节是突触传递的主要突触前机制。GPCR 位于突触前末端,激活 GPCRs 可以降低神经递质释放的概率。这种突触前抑制涉及 Gi/o 型的 G 蛋白的激活,介导不同的抑制机制,包括抑制电压门控钙离子通道、激活钾离子通道,或直接抑制囊泡融合过程。一个例子是内源性大麻素,其在突触后神经元合成和释放,通过逆向信号通路(突触后神经元合成与释放的分子反向作用到突触前末梢),作用于突触前膜的同源受体,比如 CB1 受体,引起短期(STD)或长期的突触抑制(LTD),导致短期或长期神经递质释放减少[18]。
References
- ↑ 1.0 1.1 Foster, M.; Sherrington, C.S. (1897). Textbook of Physiology, volume 3 (7th ed.). London: Macmillan. p. 929.
- ↑ Perea, G.; Navarrete, M.; Araque, A. (August 2009). "Tripartite synapses: astrocytes process and control synaptic information". Trends in Neurosciences. Cambridge, MA: Cell Press. 32 (8): 421–431. doi:10.1016/j.tins.2009.05.001. PMID 19615761. S2CID 16355401.
- ↑ Missler, M; Südhof, TC; Biederer, T (2012). "Synaptic cell adhesion". Cold Spring Harb Perspect Biol. 4 (4): a005694. doi:10.1101/cshperspect.a005694. PMC 3312681. PMID 22278667.
- ↑ Schacter, Daniel L.; Gilbert, Daniel T.; Wegner, Daniel M. (2011). Psychology (2nd ed.). New York: Worth Publishers. p. 80. ISBN 978-1-4292-3719-2. LCCN 2010940234. OCLC 696604625. https://archive.org/details/psychology0000scha.
- ↑ Palay, Sanford (1956). "Synapses in the central nervous system". J Biophys Biochem Cytol. 2 (4): 193–202. doi:10.1083/jcb.2.4.193. PMC 2229686. PMID 13357542.
- ↑ Elias, Lorin J.; Saucier, Deborah M. (2006). Neuropsychology: Clinical and Experimental Foundations. Boston: Pearson/Allyn & Bacon. ISBN 978-0-20534361-4. LCCN 2005051341. OCLC 61131869.
- ↑ "synapse". Online Etymology Dictionary. Archived from the original on 2013-12-14. Retrieved 2013-10-01.
- ↑ Tansey, E.M. (1997). "Not committing barbarisms: Sherrington and the synapse, 1897". Brain Research Bulletin. Amsterdam: Elsevier. 44 (3): 211–212. doi:10.1016/S0361-9230(97)00312-2. PMID 9323432. S2CID 40333336.
The word synapse first appeared in 1897, in the seventh edition of Michael Foster's Textbook of Physiology.
- ↑ De Robertis, Eduardo D.P.; Bennett, H. Stanley (1955). "Some features of the submicroscopic morphology of synapses in frog and earthworm" (PDF). Journal of Biophysical and Biochemical Cytology. 1 (1): 47–58. doi:10.1083/jcb.1.1.47. PMC 2223594.
- ↑ Palay, Sanford L.; Palade, George E. (1955). "The fine structure of neurons" (PDF). Journal of Biophysical and Biochemical Cytology. 1 (1): 69–88. doi:10.1083/jcb.1.1.69. PMC 2223597.
- ↑ Silverthorn, Dee Unglaub (2007). Human Physiology: An Integrated Approach. Illustration coordinator William C. Ober; illustrations by Claire W. Garrison; clinical consultant Andrew C. Silverthorn; contributions by Bruce R. Johnson (4th ed.). San Francisco: Pearson/Benjamin Cummings. p. 271. ISBN 978-0-8053-6851-2. LCCN 2005056517. OCLC 62742632.
- ↑ Lynch, M. A. (January 1, 2004). "Long-Term Potentiation and Memory". Physiological Reviews. 84 (1): 87–136. doi:10.1152/physrev.00014.2003. PMID 14715912.
- ↑ Krugers, Harm J.; Zhou, Ming; Joëls, Marian; Kindt, Merel (October 11, 2011). "Regulation of Excitatory Synapses and Fearful Memories by Stress Hormones". Frontiers in Behavioral Neuroscience. Switzerland: Frontiers Media SA. 5: 62. doi:10.3389/fnbeh.2011.00062. PMC 3190121. PMID 22013419.
- ↑ Stanley, EF (1992). "The calyx-type synapse of the chick ciliary ganglion as a model of fast cholinergic transmission". Canadian Journal of Physiology and Pharmacology. 70 Suppl: S73-7. doi:10.1139/y92-246. PMID 1338300.
- ↑ Arimura, Nariko; Kaibuchi, Kozo (December 22, 2005). "Key regulators in neuronal polarity". Neuron. Cambridge, MA: Cell Press. 48 (6): 881–884. doi:10.1016/j.neuron.2005.11.007. PMID 16364893.
- ↑ 16.0 16.1 Kimata, Tsubasa; Tanizawa, Yoshinori; Can, Yoko; et al. (June 1, 2012). "Synaptic Polarity Depends on Phosphatidylinositol Signaling Regulated by myo-Inositol Monophosphatase in Caenorhabditis elegans". Genetics. Bethesda, MD: Genetics Society of America. 191 (2): 509–521. doi:10.1534/genetics.111.137844. PMC 3374314. PMID 22446320.
- ↑ Tanizawa, Yoshinori; Kuhara, Atsushi; Inada, Hitoshi; et al. (December 1, 2006). "Inositol monophosphatase regulates localization of synaptic components and behavior in the mature nervous system of C. elegans". Genes & Development. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. 20 (23): 3296–3310. doi:10.1101/gad.1497806. PMC 1686606. PMID 17158747.
- ↑ Lovinger, David M. (2008), "Presynaptic Modulation by Endocannabinoids", in Südhof, Thomas C.; Starke, Klaus (eds.), Pharmacology of Neurotransmitter Release, Handbook of Experimental Pharmacology (in English), vol. 184, Springer Berlin Heidelberg, pp. 435–477, doi:10.1007/978-3-540-74805-2_14, ISBN 9783540748052, PMID 18064422
Category:Signal transduction
类别: 信号转导
This page was moved from wikipedia:en:Synapse. Its edit history can be viewed at 突触/edithistory