“生命之流(4)——热量中的时间之箭”的版本间的差异
(创建页面,内容为“{{#seo: |keywords=生命的本质,生命起源,复杂系统,系统理论方法,生命之流 |description=生命的本质,生命起源,复杂系统 }} * 作者:j…”) |
(没有差异)
|
2020年10月15日 (四) 13:17的最新版本
- 作者:jake
- 时间:2008-04
生命之流(4)——热量中的时间之箭
上一章探讨的是经典物理世界,在那里系统的构成相对简单。本章将走入热力学的世界,我们面对的不再是简单的小球和弹簧,而是一个个庞大的热力学机器。更有意思的是,正是在热力学中,人们发现了牛顿力学世界中看不见的时间之箭。
我们的故事要从一种可以永远运动,并能源源不断地输出能量的机器讲起,这类机器就被称为永动机。永动机的思想可以追溯到古印度,十三世纪这一想法被传入了欧洲。早期最著名的一个永动机方案是一个较亨内考的法国人提出来的,如下图:
它试图利用右侧球-杆较大的力矩来驱动轮子永远转下去。然而当它真正工作的时候会很快就停下来了(你知道为什么吗?)。早期的很多永动机都与这个装置类似,即能够在不消耗能量的前提下获得源源不断的能量输出,这类永动机统称第一类永动机。
随着18世纪欧洲工业革命的爆发,大规模的工业生产迫切需要解决能源的问题。假如永动机真能实现,那就意味着人们不必再为能源问题发愁了。所以,那时人们对于永动机的追求更是达到了顶峰,法国科学院甚至在1775年宣布不再审查任何关于永动机的设计方案,因为所有永动机没有一个能真正成功。 人们开始认识到,宇宙是没有免费午餐的。似乎这里面蕴藏着自然界的规律,于是在大量实验的基础上,科学家Mayer(迈尔)和Joule(焦耳)等人提出了能量的守恒与转化原理即热力学第一定律否定了第一类永动机的可能性。从上一章介绍的动力系统和状态函数的观点来看,人们终于找到了整个宇宙的状态函数:总能量,它随时间的演化符合3.3(a)所示的情况。因此整个宇宙的能量既不增加也不减少,只能从一种形式转变成另一种形式。
然而,对于永动机的梦想,还有人不死心,他们认为虽然我们不能凭空创造能量,但却可以把所居住的环境(例如空气,或者海洋)看作一个大能源库。这样,只要我们能造出一台机器,它可以不断地从环境中吸收热量,把它们转变成有用的功进行输出,因为环境的能量是非常庞大的,那么我们不一样可以创造出永恒的能源吗?这一类机器就叫做第二类永动机,它们试图从单一热源吸热而做功。
第二类永动机也无疑例外地失败了,对于这类机器的否定使科学家们提出了热力学第二定律,它告诫人们只从单一热源获取热量的永动机是不能实现的。然而,第二定律仅仅是人们从实践之中总结出来的一条经验规律,究竟为什么会有这条规律?人们还不清楚。甚至人们还不知道如何用严格的科学方法来研究它。
正在这时,一个名叫Carnot(卡诺)的小伙子提出了一个理想模型:卡诺热机,为热力学第二定律的科学表达奠定了基础。卡诺热机代表了宇宙中一切机器的机械效率的极限:任何热机的机械效率都不可能高于卡诺热机。
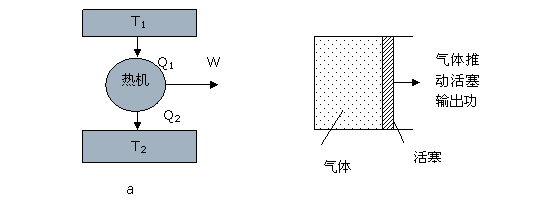
首先,我们需要说明什么是热机,如图4.2(a),热机是一种机械装置,它会从高温吸收一定热量[math]\displaystyle{ Q_1 }[/math],然后向低温热源排出废热[math]\displaystyle{ Q_2 }[/math],同时向外界输出有用功[math]\displaystyle{ W }[/math]。图4.2(b)给出了一个具体的热机的例子。该热机由一个充满气体的气缸和一个可以滑动的活塞组成。当把这套东西跟一个高温热源(温度[math]\displaystyle{ T_1 }[/math])接触,气体会受热膨胀,活塞被推动对外界输出功。再把它跟低温热源接触,气体会丢失一部分热量到低温热源去,同时它还必须再次收缩到原来的体积以便重复刚才的过程。从吸热到放热的一系列动作就是一个循环,汽车上的发动机嘣嘣跳个不停就是一直在做这个类似的循环。
我们知道,对于任何一个可用的热机,都必须满足两个条件:
(1)、这台机器需要工作在两个热源之间,一个高温热源[math]\displaystyle{ T_1 }[/math],一个低温热源[math]\displaystyle{ T_2 }[/math];
(2)、在完成一个吸热、放热循环之后,机器必须还能恢复到原状,以便再次重复这一系列动作(否则我们的机器将不能持久输出能量)。
很显然,我们希望热机的输出功[math]\displaystyle{ W }[/math]越多越好。但是它却要受很多限制,首先,根据热力学第一定律(能量守恒),[math]\displaystyle{ W\lt =Q_1 }[/math],即能量不能无中生有。其次,根据热力学第二定律,热机不能从单一热源吸热而全部转化成有用功,所以[math]\displaystyle{ Q_2\gt 0 }[/math],因此[math]\displaystyle{ W }[/math]必然小于[math]\displaystyle{ Q_1 }[/math]。在这些限制下,我们可以定义这台热机的效率为[math]\displaystyle{ e=W/Q_1 }[/math],所以[math]\displaystyle{ e }[/math]越大也就意味着[math]\displaystyle{ W }[/math]越大,但它不会大过1。那么,[math]\displaystyle{ e }[/math]能不能无限接近于1呢?卡诺告诉你,这也是不可能的。他证明,只要热机满足那两个条件,那么效率[math]\displaystyle{ e }[/math]最大也不能超过理想机器:卡诺热机所能达到的极限。
这是为什么呢?原因就在于卡诺热机的运作过程是一个理想化的过程,它忽略了所有的摩擦,而且它的运作要无限缓慢,使得每一步动作都是可逆的。如果我们把卡诺热机以及它周围的环境看作一个动力系统(牛顿力学2.0),那么上一章讨论过的可逆概念就可以用到这里来了。我们把对卡诺热机的每一步操作(例如推动一小步活塞)看作是动力系统的一次迭代(应用一次[math]\displaystyle{ f }[/math]函数),这样如果该操作是可逆的,那么必然存在一个可逆函数[math]\displaystyle{ f^{-1} }[/math]使得从之后的卡诺热机+环境的状态可以完全恢复到应用[math]\displaystyle{ f }[/math]之前的状态。我们知道忽略掉摩擦力的牛顿力学系统就是可逆的动力系统。所以,如果我们推动活塞无限缓慢,那么摩擦力的效果(摩擦力做功)可以忽略,这个过程就是可逆的。因此,卡诺热机就是可逆热机的代名词。
进一步,即使卡诺热机这样的理想机器为什么也不能使得效率达到100%呢?这是因为我们不仅要求输出能量,还要求机器能够持续地输出能量,即系统在完成了一个循环后还要回到状态原点,这就使得我们不得不耗费一些额外的能量来让系统恢复原状。理论上可以证明,工作在两个热源之间的卡诺热机效率仅仅是两个热源温度的函数,即[math]\displaystyle{ (T_1-T_2)/T_1 }[/math]。同时可以证明,任何一个工作在同样热源之间的可逆热机,其机械效率都是[math]\displaystyle{ (T_1-T_2)/T_1 }[/math],而不可逆热机的效率都会小于这个数(这一点见框中的证明)。
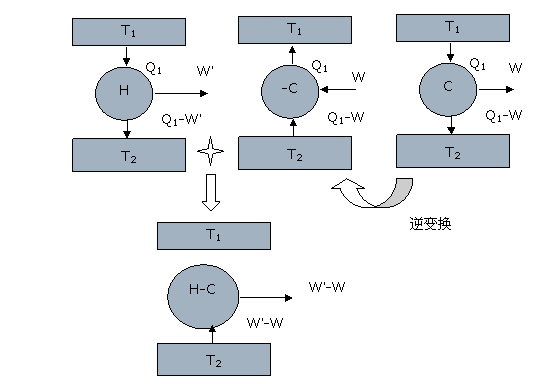
对“在相同的高温和低温热源条件下,不可逆热机的效率小于可逆热机的效率”的证明。
运用反证法,假设高于可逆热机效率的机器存在,我们设它为[math]\displaystyle{ H }[/math],它工作在热源[math]\displaystyle{ T_1 }[/math]和[math]\displaystyle{ T_2 }[/math]之间。它从高温热源吸热[math]\displaystyle{ Q_1 }[/math],做功[math]\displaystyle{ W' }[/math],向低温热源输出热量[math]\displaystyle{ Q_2 }[/math]。再考虑一个连接在[math]\displaystyle{ T_1 }[/math]和[math]\displaystyle{ T_2 }[/math]之间的卡诺热机[math]\displaystyle{ C }[/math]。假设它同样吸热[math]\displaystyle{ Q_1 }[/math],输出的功是[math]\displaystyle{ W }[/math],同时放热[math]\displaystyle{ Q_1-W }[/math]。因为我们假设H的效率大于[math]\displaystyle{ C }[/math]的,所以吸收同样的热量的时候,[math]\displaystyle{ W\lt W' }[/math]。因为卡诺热机都是可逆热机,所以我们可以把[math]\displaystyle{ C }[/math]逆过来作为一个制冷机[math]\displaystyle{ -C }[/math]使用(即循环倒转:外界对机器做功,从低温热源吸热),它在外界做功[math]\displaystyle{ W }[/math]的条件下,从低温热源吸热[math]\displaystyle{ Q_1-W }[/math],会向高温热源放出热量[math]\displaystyle{ Q_1 }[/math]。如图:
之后,我们将[math]\displaystyle{ H }[/math]与[math]\displaystyle{ -C }[/math]合并构成一个新的热机:[math]\displaystyle{ H-C }[/math],则[math]\displaystyle{ H-C }[/math]的净效果是从低温热源吸热[math]\displaystyle{ W'-W }[/math],向高温热源输出热量0,同时对外界做功[math]\displaystyle{ W'-W\gt 0 }[/math]。这与第二定律矛盾(从单一热源吸热并全部转化成功),所以在相同条件下,不可逆热机的效率要小于卡诺热机效率。
卡诺的发现为理论家们打开了一扇窗,因为卡诺热机是一个漂亮的、干净的模型,所以物理学家就可以利用数学工具来探讨热力学第二定律了。我们看到,热不能从低温物体传向高温物体、不能把全部的热转变为功等等物理现象都来源于时间的方向性——即时间之箭。联系到上一章的讨论,如果我们能够找到一个系统的状态函数,它随时间的演化是按照图3.3(b)那样趋向于一个目标,那么我们就能从数学上揭示出时间的方向性。1865年,物理学家克劳修斯(Clausius)正是作了这样的事,通过研究卡诺热机,他终于找到了这样的状态函数,从而为热力学第二定律严格的数学基础。这个重要的状态函数就是:熵。
克劳修斯的出发点是把热机看作一个动力系统,系统的状态x就是描述热机的一些宏观变量(如气缸的压强、体积、温度等等),热机的工作就看作是该系统的演化规律[math]\displaystyle{ f }[/math]。按照上一章的讨论,我们希望找到一个状态的函数[math]\displaystyle{ S(x) }[/math],使得该函数能够表示系统随时间演化的总趋势。
让我们先就卡诺理想热机来讨论。我们知道卡诺热机的工作是循环往复的,这意味着当热机从初始状态[math]\displaystyle{ x_1 }[/math]出发,经过吸热、放热循环之后到了状态[math]\displaystyle{ x_2 }[/math],那么这两个状态必须相同才保证系统能够循环往复:[math]\displaystyle{ x_1=x_2 }[/math],所以它们对应的[math]\displaystyle{ S }[/math]数值也应该相同,即[math]\displaystyle{ S(x_2)=S(X_1) }[/math],这也意味着系统从状态[math]\displaystyle{ x_1 }[/math]变到状态[math]\displaystyle{ x_2 }[/math],[math]\displaystyle{ \Delta S=0 }[/math]。这是对[math]\displaystyle{ S }[/math]的基本要求。
另一方面,我们又知道卡诺热机的机械效率定义为[math]\displaystyle{ (Q_1-Q_2)/Q_1 }[/math],它等于[math]\displaystyle{ (T_1-T_2)/T_1 }[/math],即:
我们看到,在最后一个等式中,每一项都写成了Q/T的形式,如果规定热机吸热为正,放热为负的话,那么最后一个等式就具有[math]\displaystyle{ \sum_i \Delta Q_i/T_i }[/math]的形式[math]\displaystyle{ i=1,2 }[/math]。而该等式告诉我们这个和式为0,这个量刚好满足上面所说的对于[math]\displaystyle{ \Delta S }[/math]函数的要求,因此克劳修斯猜,也许这恰恰是对熵变的一个定义:
其中[math]\displaystyle{ i }[/math]表示整个可逆循环过程中的第[math]\displaystyle{ i }[/math]个小过程(可以设想可逆循环通过很多个小的步骤完成)。[math]\displaystyle{ Q_i }[/math]表示这个小过程中吸收的热量,[math]\displaystyle{ T_i }[/math]则表示这个小过程中系统的温度。假如卡诺热机所经历的小过程(可逆的)无限多,每个小过程又是无限缓慢,我们就可以定义状态函数熵的小变化为:
其中[math]\displaystyle{ dQ }[/math]为小过程吸收的热量,而[math]\displaystyle{ dS }[/math]为小过程中的熵变。(2)和(3)是等价的表达方法,只不过(3)表达的是每个小过程的熵变,它蕴含了(2)即整个过程的熵变。当整个过程是循环的时候,熵变就刚好为0。实际上,(2)和(3)并没有直接给出状态函数熵S(x)或熵变函数具体是什么样子,而是给出了度量熵变化的一种间接方法,即用可逆过程中的dQ/T来计算它,所以(2)和(3)也叫做熵变的定义式。根据该式,如果温度保持不变,那么熵变化的数值和系统吸收的热量就成正比。吸收热量会让熵增加;放出热量熵就减少。因为热是一种不能被系统利用来做功的能量,所以熵变也就度量了系统做功能力的损失或者不可做功的能力的增加。熵的增加和温度密切相关,即温度越高吸收同样的热量,其熵增加也越小,且反之亦然。
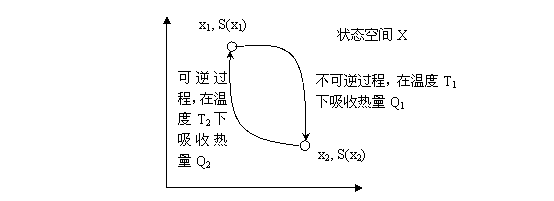
下面再来考虑不可逆过程。假设系统经历一个不可逆过程从状态x1变到了x2,那么我们是否还可以运用(2)和(3)式来计算[math]\displaystyle{ x_1 }[/math]到[math]\displaystyle{ x_2 }[/math]的熵变呢?为了回答这个问题,让我们设计这样一台特殊的热机(如图4.4):当热机在高温热源[math]\displaystyle{ T_1 }[/math]吸热[math]\displaystyle{ Q_1 }[/math]的时候,系统经历一条不可逆路径从状态[math]\displaystyle{ x_1 }[/math]变到状态[math]\displaystyle{ x_2 }[/math],而当热机在低温热源[math]\displaystyle{ T_2 }[/math]放热[math]\displaystyle{ Q_2 }[/math]的时候,该热机进行可逆的变化从状态[math]\displaystyle{ x_2 }[/math]变到[math]\displaystyle{ x_1 }[/math]。这样,对热机的可逆过程部分我们可以定义熵变,即:[math]\displaystyle{ S_{x_1}-S_{x_2} = -Q_2/T_2 }[/math],而总过程显然是不可逆的,所以它的效率一定小于相同温差下的可逆热机效率,所以:
即对于一个不可逆过程,系统总的熵变要大于系统吸收的热量除以温度。同样,如果不可逆过程由无限多个小过程构成,那么对于每一个小过程,我们有:
对于不可逆过程,等式(3)并不成立,取而代之的是不等式(5)。所以综合这两种情况,对于大自然的任何一种自然变化过程(无非就是可逆和不可逆两种)来说,
这说明,如果系统吸热,那么它的熵就增加,这个熵增加的最小值是[math]\displaystyle{ dQ/T }[/math]。
对于一个孤立系统(不与外界进行能量与物质的交换的系统)来说,因为系统没有从外界吸收热量,所以[math]\displaystyle{ dQ=0 }[/math],这就导致了:
即孤立系统总是要熵增加的,这便是克劳修斯表述的热力学第二定律, 也是第二定律的数学表达形式!克劳修斯的确找到了一个系统的状态函数[math]\displaystyle{ S }[/math],它随时间的变化类似于图3.3(b)所示的情况。因此我们也可以说,对于任意的孤立系统来说,它都有一个目的:让熵趋向最大化。
可以说,热力学第二定律是物理中的一个新的“公理”,因为我们在牛顿力学框架中根本找不到它的影子。但是不可逆的宏观现象逼迫我们必须提出新的公理来解释它们。这样,被牛顿力学模型中“理想化”掉的那些因素,如摩擦、阻力等等又重新被纳入到了热力学第二定律中。克劳修斯的最大贡献在于找到了一种状态变量:熵来模型化热力学第二定律,并且它给熵找到了一种间接的度量方法。打开的香水会挥发到整个房间、破碎的镜子不能重圆,热量不能自发从低温流向高温,所有这些时间不可逆现象都归结于热力学第二定律,它告诉我们孤立系统的唯一目的就是使熵获得增加,这一论述构成了所有不可逆现象的原型。